多巴胺細胞替代療法是帕金森病的一種潛在治療方法,旨在通過直接替換大腦中因病理過程而丟失的部分細胞來治療該疾病。
近日,知名期刊雜志《帕金森病雜志》發表了一篇“Clinical trial highlights: Dopamine cell-replacement therapies”(治療帕金森病的臨床試驗亮點:多巴胺能神經元替代療法)的研究綜述[1]。
這項綜述討論了歷年來胚胎、誘導多能干細胞衍生多巴胺細胞替代療法治療帕金森病的臨床試驗現狀(共計16項)。
疾病背景:多巴胺缺失與治療瓶頸
帕金森病(PD)的核心病理在于中腦黑質多巴胺能神經元的變性丟失。當這類神經元減少約一半時,患者便會出現明顯的運動障礙。雖然自20世紀60年代起,左旋多巴等藥物治療已成為臨床標準,但長期使用往往會引發癥狀波動、運動障礙及神經精神副作用。這種傳統藥物療法的局限性,促使醫學界不斷探索深部腦刺激(DBS)等新技術,以及更具針對性的多巴胺能細胞替代療法。

早期探索:胎兒組織移植的初步嘗試
20世紀80至90年代,以隆德大學為首的研究機構率先開展了細胞替代療法實驗。研究者嘗試將發育中的人類胎兒腹側中腦(hfVM)細胞植入患者紋狀體。雖然早期的病例系列研究證實了移植細胞存活的安全性與可行性,但臨床效果卻呈現出巨大的個體差異:部分患者甚至可以多年停藥,而另一些患者則毫無獲益,這種不確定性為該療法的后續發展埋下了伏筆。
臨床挫折:雙盲試驗的失利與挑戰
20世紀90年代后期,由美國國立衛生研究院資助的兩項大規模雙盲對照試驗結果令人沮喪。這兩項研究不僅未能達到主要療效終點,還發現相當一部分患者出現了“移植誘發運動障礙(GIDs)”等副作用。這一沉重打擊導致相關臨床試驗一度陷入停滯,也迫使學術界開始深入反思失敗原因,包括移植細胞的均勻度、組織劑量、免疫抑制方案以及血清素神經元的潛在干擾。
未來曙光:標準化來源與干細胞技術
為了解決胎兒組織來源不穩定及臨床效果不一的問題,歐盟資助的TransEuro試驗嘗試優化方案,卻因組織供應短缺而進展緩慢。這一困境明確了臨床應用的先決條件:必須擁有穩定且可靠的細胞來源。2011至2012年間,利用人類多能干細胞定向分化為中腦多巴胺細胞的技術取得突破,為實現標準化、規模化的帕金森病細胞治療帶來了全新的希望。
首個針對帕金森病患者的干細胞衍生多巴胺能細胞替代療法試驗于2015年啟動,迄今為止已有16項試驗開始——詳見下文。我們檢索了ClinicalTrials.gov和世界衛生組織臨床試驗注冊庫,查找任何使用干細胞衍生多巴胺細胞治療帕金森病的試驗。大多數試驗仍在進行中,該領域尚處于早期發展階段,因此其安全性和有效性尚未得到證實。
人類胚胎干細胞衍生多巴胺能細胞治療帕金森病的試驗(表1)
人類胚胎干細胞(hESC)衍生細胞以受精后第4/5天單個人類胚胎內細胞團中分離的多能干細胞為原始細胞來源。這些細胞可在體外擴增,目前已建立多種臨床級hES細胞系。這些多能干細胞可在體外分化為多巴胺能前體細胞。
這種方法可實現“即用型”治療,細胞產品可冷凍保存并大規模生產,達到臨床標準,且每批產品均可進行質量控制檢測。該方法產生的是同種異體產品,多巴胺能細胞在植入后成熟,因此移植后需要某種形式的免疫抑制治療。
01、標題:人胚胎干細胞衍生神經前體細胞治療帕金森病的安全性和有效性研究
階段:I/II
開始日期:2015年
狀態:未知
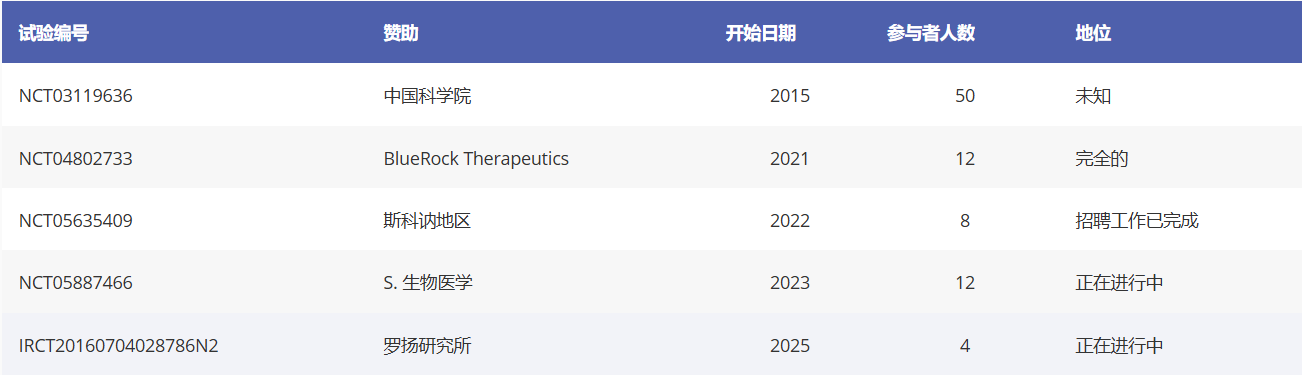
臨床試驗編號:NCT03119636
贊助方:中國科學院
國家:中國

研究設計:一項開放標簽試驗,采用立體定向紋狀體內注射單劑量多巴胺能神經前體細胞。本研究計劃納入50例年齡在50至80歲之間的晚期帕金森病(Hoehn和Yahr [HY]分級3期或4期)患者。主要終點為安全性,評估不良事件的數量和性質。
備注:這是首個嘗試將干細胞衍生的多巴胺能移植應用于帕金森病患者的臨床試驗。目前尚未公布臨床數據。
02、標題:評估人胚胎干細胞衍生中腦多巴胺神經元細胞療法(MSK-DA01)治療晚期帕金森病的安全性和耐受性的I期研究
階段:I
開始日期:2021年
狀態:已完成
臨床試驗編號:NCT04802733
贊助商:BlueRock Therapeutics
國家:美國/加拿大

研究設計:一項開放標簽試驗,通過殼核內注射給予胚胎干細胞來源的多巴胺能祖細胞產品(Bemdaneprocel)。試驗招募了兩組患者,分別測試180萬和540萬個細胞的劑量,共納入12名患者。試驗招募了年齡在50至78歲之間的晚期帕金森病患者。
主要終點是移植后12個月的安全性和耐受性,次要終點包括移植后1年和2年時通過18F-DOPA PET成像評估的細胞存活率以及通過統一帕金森病評定量表(UPDRS)評估的運動評分變化。
評論:該試驗于2022年完成招募,并報告稱,移植后24個月,高劑量組和低劑量組均對該產品耐受性良好。他們還報告稱,在“關期”狀態下,高劑量組的UPDRS第三部分評分平均降低了23分,而低劑量組僅降低了8.6分,這表明運動反應存在劑量依賴性,并于今年四月份公布了臨床1期的臨床結果。
基于該試驗,BlueRock Therapeutics/Bayer近期宣布計劃將Bemdaneprocel產品推進至III期注冊試驗,該試驗采用安慰劑對照設計。
03、標題:一項旨在確定移植干細胞衍生多巴胺神經元對帕金森病患者大腦的安全性和耐受性的試驗(STEM-PD)
階段:I
開始日期:2022年
狀態:進行中,招聘已完成
臨床試驗編號:NCT05635409
贊助商:斯堪納地區
國家:瑞典/英國

研究設計:一項開放標簽試驗,通過殼核內注射給予胚胎干細胞來源的多巴胺能祖細胞產品(STEM-PD)。試驗招募了兩組各4名患者,分別測試兩種劑量的700萬和1400萬個細胞(共8名患者)。受試者為50-75歲、中度帕金森病(Hoehn-Yahr分期2-3期,處于“關期”)的帕金森病患者。
主要終點是安全性,通過移植后12個月的不良事件數量和性質進行評估;次要終點包括臨床特征的變化,例如通過統一帕金森病評定量表(UPDRS)第三部分記錄的運動癥狀。
評論:該試驗于2024年完成招募和移植,最新消息指出,開創性的STEM-PD臨床試驗已推進至更高劑量階段。這標志著歐洲首次開展針對腦部疾病的多能干細胞療法試驗。
04、標題:評估胚胎干細胞衍生多巴胺祖細胞療法在帕金森病患者中的安全性和有效性的研究
階段:I/II
開始日期:2023年
狀態:進行中
臨床試驗編號:NCT05887466
贊助商:S. Biomedics
國家:韓國

研究設計:一項開放標簽試驗,通過殼核內注射給予胚胎干細胞來源的多巴胺能祖細胞產品(A9-DPC)。已招募兩組各6名患者,分別測試315萬和630萬兩種劑量的細胞。該試驗招募50-75歲、處于晚期帕金森病(HY3-4期,處于“關期”)的帕金森病患者。主要終點是24個月時的安全性,評估細胞產品給藥后治療相關不良事件的發生情況和性質。
2025年4月,該試驗報告稱,12個月時安全性良好。且低劑量和高劑量治療組患者的運動功能評分較植入前均提高了高達28.9%。低劑量和高劑量組患者的精神和情緒癥狀以及自主神經癥狀也均得到顯著改善。
05、標題:帕金森病患者紋狀體內移植人胚胎干細胞來源的多巴胺能祖細胞(DopaCell)的安全性和可行性評估:一項多中心I期臨床試驗
開始日期:2025年
狀態:進行中
臨床試驗編號:IRCT20160704028786N2
贊助方:羅揚研究所
國家:伊朗
研究設計:開放標簽試驗,通過紋狀體內注射給藥干細胞來源的多巴胺能前體細胞產品(DopaCell)。本試驗計劃招募4名患者,測試單次1000萬細胞劑量。招募對象為30-70歲、處于OFF狀態且病程達帕金氏病III期的患者。主要終點為安全性與可行性,通過移植后12個月內不良事件的發生率及性質進行評估。
人類誘導多能干細胞衍生多巴胺能細胞試驗(表2)
人類誘導多能干細胞(iPSCs)是直接來源于體細胞的多能干細胞。體外實驗中,通過引入轉錄因子混合物,可將體細胞誘導為多能干細胞。這些多能干細胞隨后可在體外進一步分化為多巴胺能神經元。
由于iPSCs可以直接來源于患者自身的細胞(例如,皮膚活檢中的成纖維細胞或循環血細胞),這使得自體細胞移植成為可能,理論上可以避免使用免疫抑制療法。然而,這種高度個性化的自體治療方法并非沒有風險,例如其生產成本較高,以及由于細胞來源于帕金森病患者自身,其療效可能較差。
目前,已建立并保存了多個臨床級iPSC細胞系,因此,異體iPSC衍生多巴胺能細胞以及自體移植的臨床試驗正在進行中。
06、標題:通過自體干細胞衍生多巴胺能神經元移植治療帕金森病
階段:I/II
開始日期:2017年(n=1),2024年
狀態:進行中
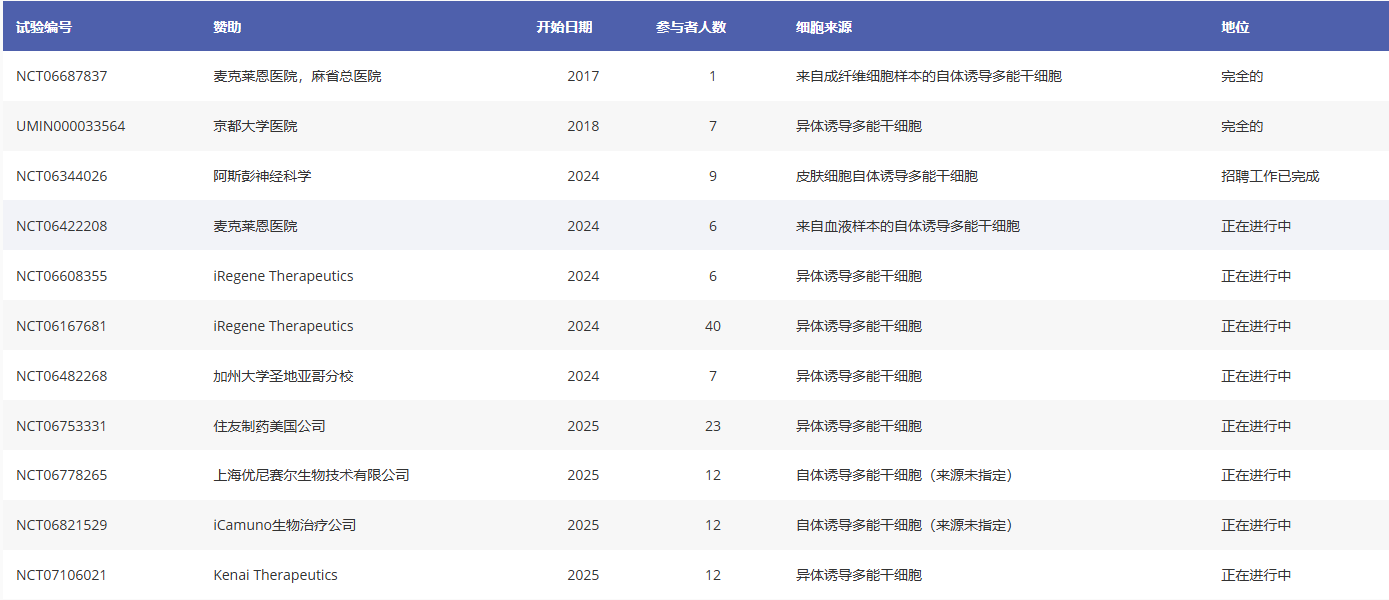
臨床試驗編號:NCT06687837
贊助方:麥克萊恩醫院、麻省總醫院
國家:美國

研究設計:一項開放標簽試驗,將自體誘導多能干細胞(iPSCs)衍生的多巴胺能祖細胞(由患者成纖維細胞樣本制備)移植到患者體內。細胞將通過殼核內注射進行移植。試驗將招募8名患者,并測試兩種劑量(800萬和1600萬個細胞)。受試者為45至80歲、處于帕金森病晚期(HY3-4期)且處于“關期”的帕金森病患者。主要終點是安全性,通過記錄移植后2年不良事件的發生率和嚴重程度來評估。
評論:這項于2024年開始的臨床試驗建立在2020年發表的采用相同方法的一個病例的結果之上。在該病例中,24個月內沒有發生嚴重不良事件,并且使用PDQ-39患者問卷調查顯示,術后18至24個月,帕金森病癥狀的臨床指標穩定或有所改善。

07、標題:京都試驗評估iPSC衍生多巴胺能祖細胞治療帕金森病的安全性和有效性
階段:I/II
開始日期:2018年
狀態:已完成
臨床試驗編號:UMIN000033564
贊助方:京都大學醫院
國家:日本
研究設計:一項開放標簽試驗,采用殼核內注射的方式,將異體誘導多能干細胞(iPSC)來源的多巴胺能前體細胞移植到患者體內。共招募了7名患者,分別接受4.2–5.2M(n=3)和10.6–11M(n=4)兩種劑量的細胞。受試者為50–70歲、處于晚期帕金森病(HY3–4期,處于“關期”)的帕金森病患者。主要終點為移植后24個月的安全性以及移植物是否擴增。
評論:該試驗已完成,未報告嚴重不良事件,UPDRS第三部分評分平均降低9.5 分。值得注意的是,該試驗使用了來自供體的異基因誘導多能干細胞 (iPSC),該供體的HLA基因型與17%的日本人口相匹配,但受試者并未在試驗中進行特定的HLA匹配,且移植后使用了免疫抑制劑。
該試驗中的細胞產品(也稱為CT1-DAP001或DSP-1083)已由住友制藥公司用于兩項后續研究,這兩項研究均采用開放標簽和假對照設計(見下文)。
08、標題:ANPD001治療帕金森病的1/2a期研究(ASPIRO)
階段:I/II
開始日期:2024年
狀態:進行中
臨床試驗編號:NCT06344026
贊助商:阿斯彭神經科學
國家:美國

研究設計:一項開放標簽試驗,旨在評估自體誘導多能干細胞(iPSCs)衍生的多巴胺能祖細胞在治療中的應用效果。該iPSCs由患者自身的皮膚細胞制備而成。試驗計劃招募9名患者,分為兩組,分別接受1000萬或1500萬至2000萬個細胞的殼核內注射。受試者為45至80歲、處于晚期帕金森病(HY3-4期,處于“關期”)的帕金森病患者。
主要終點為移植后2年的安全性,通過不良事件的發生率和嚴重程度進行評估。
評論:該試驗已于2025年1月完成招募和移植,迄今為止未報告任何嚴重不良事件。
09、標題:自體iPSC衍生多巴胺神經元移植治療帕金森病
階段:I
開始日期:2024年
預計結束日期:2027-12-31
狀態:進行中
臨床試驗編號:NCT06422208
贊助商:麥克萊恩醫院
國家:美國

研究設計:一項開放標簽試驗,將患者自體來源的誘導多能干細胞(iPSCs)衍生的多巴胺能祖細胞(由患者自身血細胞生成)移植到患者體內。試驗將招募6名患者,所有患者均接受相同數量的細胞(劑量未公開),通過殼核內注射的方式進行移植。試驗對象為年齡在55至80歲之間、確診帕金森病至少5年的帕金森病患者。
主要終點是移植后2年的安全性,通過不良事件的發生率和嚴重程度來評估。
10、標題:NouvNeu001治療早發性帕金森病的安全性、耐受性和初步療效
階段:I
開始日期:2024年
狀態:進行中
臨床試驗編號:NCT06608355
贊助商:iRegene Therapeutics
國家:中國

研究設計:一項開放標簽試驗,旨在評估異基因誘導多能干細胞(iPSCs)來源的多巴胺能祖細胞移植療效。將招募6名患者,通過紋狀體內注射單次給藥(劑量未公開)。試驗將招募年齡在18至70歲之間、發病年齡小于50歲且處于“關期”(OFF狀態)的帕金森病患者(PwP)。主要終點是移植后96周的安全性,通過不良事件的發生率和嚴重程度進行評估。
2025年7月,睿健毅聯醫藥科技(成都)有限公司宣布其自主研發的NouvNeu001 注射液療中重度帕金森的II期臨床試驗在北京醫院已成功完成首例入組給藥。

NouvNeu001注射液針對帕金森病,提供了細胞替代療法的新思路,于2023年8月獲得中國 NMPA 批準進入臨床階段,成為全球首個進入臨床的化學誘導iPSC衍生治療產品,并于2024年6月獲得美國FDA批準開展海外臨床研究,實現了中美IND「雙報雙批」。
11、標題:NouvNeu001治療帕金森病的安全性、耐受性和有效性
階段:I/II
開始日期:2024年
狀態:進行中
臨床試驗編號:NCT06167681
贊助商:iRegene Therapeutics
國家:中國

研究設計:一項開放標簽試驗,旨在評估異基因誘導多能干細胞(iPSCs)來源的多巴胺能祖細胞移植療效。將招募40名患者,通過紋狀體內注射單次給藥(劑量未公開)。試驗對象為50-75歲、處于“關期”(OFF狀態)的帕金森病患者(PwP)。主要終點為移植后24周和48周的安全性,以及移植后24周的運動功能(以UPDRS第三部分評分的變化衡量)。
備注:NovNeu001異體iPSC衍生多巴胺能產品正與上述I期研究并行進行測試。此外,兩項研究招募的患者群體也存在差異:I期研究招募的是早發型帕金森病患者,而I/II期研究則招募的是發病年齡更為典型的帕金森病患者。
12、標題:移植人類iPS細胞衍生的多巴胺能祖細胞(CT1-DAP001)治療帕金森病(I/II期)
階段:I/II
開始日期:2024年
狀態:進行中完成日期:2028年5月(估計的)
臨床試驗編號:NCT06482268
贊助方:加州大學圣地亞哥分校
國家:美國

研究設計:一項開放標簽試驗,旨在評估異基因誘導多能干細胞(iPSCs)來源的多巴胺能祖細胞的療效。將招募7名患者,通過殼核內注射單次劑量840萬至1080萬個細胞。試驗將招募40至75歲、處于“關期”(OFF狀態)且HY分期≥2的帕金森病患者(PwP)。
主要終點為安全性,通過治療期間出現的不良事件的發生率和嚴重程度,以及移植后24個月F-DOPA顯像上是否存在移植物擴增來評估。
13、標題:一項評估DSP-1083在帕金森病患者中安全性、耐受性和臨床反應的多中心研究
階段:I
開始日期:2025年
狀態:進行中
臨床試驗編號:NCT06753331
贊助商:住友制藥美國公司
國家:美國

研究設計:一項雙隊列研究,通過殼核內注射給予源自同種異體誘導多能干細胞(iPSCs)的多巴胺能祖細胞。先導隊列(n=3)將接受540萬個細胞,第二隊列(n = 20)將以1:1的比例隨機分組,分別接受540萬個細胞或假手術(雙側部分厚度顱骨鉆孔術)。
該試驗將招募40-70歲、處于“關期”且Hoehn-Yahr分期≥3的帕金森病患者。先導隊列的參與者必須為亞裔,而第二隊列的參與者將來自任何種族。
主要終點是安全性(通過不良事件的數量和性質進行評估)和臨床反應(通過神經精神評估和移植后104周PET成像中F-DOPA攝取的變化進行評估)。
2025年8月,日本住友制藥(Sumitomo Pharma)與 Racthera 聯合宣布,已向監管機構提交同種異體iPS細胞衍生多巴胺能神經祖細胞(通用名:raguneprocel)的生產與上市許可申請,用于改善中晚期帕金森病患者「關期」運動功能。

這一里程碑事件標志著干細胞再生醫學療法在神經系統疾病治療領域的臨床轉化進入關鍵階段,有望為全球約1000萬帕金森病患者帶來首個從病理機制層面解決問題的根治性療法。
14、標題:UX-DA001治療特發性帕金森病患者的探索性臨床研究
階段:I
開始日期:2025年
狀態:進行中
臨床試驗編號:NCT06778265
贊助商:上海優尼賽爾生物技術有限公司
國家:中國

研究設計:一項開放標簽試驗,旨在通過殼核內注射的方式,將多巴胺能祖細胞(源自自體誘導多能干細胞)導入患者體內。試驗將招募12名患者,分為兩個劑量組(劑量未公開)。受試者為年齡在50至75歲之間、處于“關期”的帕金森病患者(PwP),其Hoehn-Yahr分期為3至4期。
主要終點為安全性,通過移植后4周和2年時不良事件的發生率和嚴重程度進行評估。
在2025年10月5日至9日于美國夏威夷檀香山舉行的國際帕金森病和運動障礙大會(MDS 2025)的“最新突破”報告環節,該項I期試驗首例患者接受UX-DA001后6個月的積極數據正式公布。
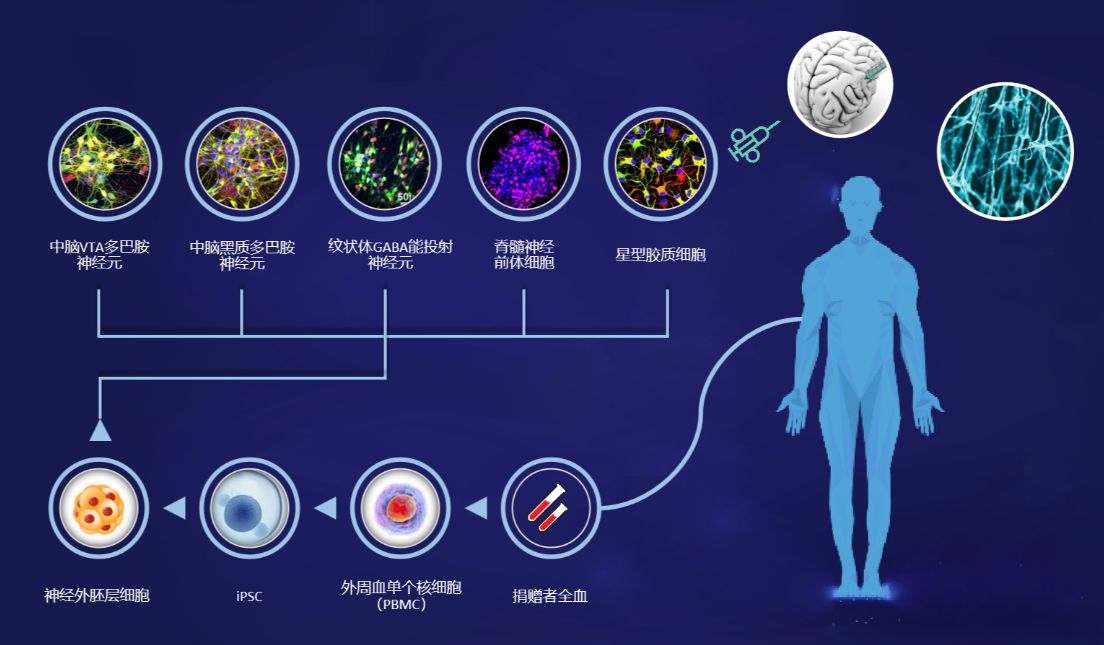
據報告,首例患者的6個月隨訪數據顯示,UX-DA001具有良好安全性和顯著療效。
15、標題:立體定向腦內注射IPSC-DAP治療帕金森病
階段:1
開始日期:2025年
狀態:進行中
臨床試驗編號:NCT06821529
贊助商:iCamuno Biotherapeutics
國家:中國

研究設計:一項開放標簽試驗,旨在研究自體誘導多能干細胞(iPSCs)來源的多巴胺能祖細胞的移植。將招募12名患者,通過殼核內注射給予800萬個細胞。試驗對象為年齡在39至75歲之間、處于“關期”(OFF狀態)的帕金森病患者(PwP)。主要終點是安全性,通過移植后12個月的不良事件發生率和嚴重程度來評估。
16、標題:評估RNDP-001外科植入治療特發性帕金森病患者的安全性和有效性的研究
階段:1b/2a
開始日期:2025年
狀態:進行中
臨床試驗編號:NCT07106021
贊助商:Kenai Therapeutics
國家:美國

研究設計:一項開放標簽試驗,旨在通過殼核內注射的方式,將源自同種異體誘導多能干細胞(iPSCs)的多巴胺能祖細胞移植給帕金森病患者。試驗將招募12名患者,接受三種劑量(未具體說明)的治療。受試者為45至75歲的帕金森病患者。主要終點是安全性,通過移植后15個月時不良事件的發生率和嚴重程度來評估。
2025年12月16日,Kenai公司在帕金森病細胞療法I期臨床試驗中為首位患者給藥。預計2026年將公布參與者的耐受性、安全性和腦成像方面的初步數據。

總結與展望
01、現狀與前景:干細胞療法開啟新紀元
多巴胺細胞替代療法正從實驗室走向臨床應用的新階段,首批基于干細胞衍生的神經元前體細胞試驗已展示出初步成果。相比于現有的多巴胺泵療法或深部腦刺激(DBS),細胞療法的核心優勢在于其“單次治療”的潛力,有望擺脫長期的侵入性隨訪。
盡管細胞療法無法像DBS那樣隨時調節劑量,但隨著分化方案的標準化和規模化,其成本競爭力正逐漸顯現,甚至可能通過改善患者的功能水平來降低長期的社會經濟負擔。
02、策略與考量:尋找移植的“最佳時機”
目前的臨床試驗主要聚焦于中度帕金森病患者。這一選擇平衡了倫理安全與療效檢測的需求:早期患者尚無必要接受此類干預,而晚期患者風險過高。
然而,精準篩選患者面臨挑戰,因為移植細胞需要數年時間才能生長、支配神經并發揮功能。因此,理想的受試者必須能夠耐受數年的“窗口期”,這要求醫生在患者病情惡化到必須接受其他高級療法之前,精準把握移植的介入節點。
03、試驗設計:安慰劑對照與監管爭議
在未來的臨床試驗設計中,是否設置“假手術”對照組成為爭議焦點。雖然安慰劑效應在神經外科干預中普遍存在,但由于細胞療法的預期療效遠超安慰劑,且可以通過18F-DOPA PET影像客觀觀察紋狀體多巴胺的恢復情況,許多研究者認為不再需要設置假手術組。
此外,在信息高度透明的今天,維持長期雙盲手術的難度也顯著增加,這使得試驗設計更多地取決于各國監管機構(如FDA)的審查意向。
04、未來路徑:個體化篩選與大數據支持
盡管多巴胺細胞療法展現了改變疾病自然病程的巨大潛力,但哪些患者獲益最大、免疫抑制應持續多久等關鍵問題仍無定論。
未來需要建立全球性的中央登記系統,通過對大規模臨床數據的薈萃分析,識別出最適合移植的患者亞群。雖然這種療法不能徹底治愈帕金森病(無法阻斷變性進程),但它有望通過減少口服藥物需求及其副作用,顯著提升患者的生活質量,使“細胞替代”成為具競爭力的治療方案。
主要參考資料:
[1]:1.Kayhanian S, Barker RA. Clinical trial highlights: Dopamine cell-replacement therapies. Journal of Parkinson’s Disease. 2025;0(0). doi:10.1177/1877718X251397277.
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加官方微信
掃碼添加官方微信