肌萎縮側索硬化癥(ALS)是一種累及上、下運動神經元的進行性神經退行性疾病,嚴重影響患者的生活質量。該疾病涉及遺傳與環境因素之間復雜的相互作用,這給治療研發帶來了巨大挑戰。目前可用于ALS的疾病修飾藥物療效有限,僅能輕微延緩疾病進展。

肌萎縮側索硬化癥的多元治療方法——藥物、基因與干細胞療法的進展與展望
近期,已獲批藥物AMX0035的撤市,進一步凸顯了該領域面臨的困境。與此同時,針對ALS及相關神經退行性疾病的生物靶點研究,為治療干預提供了獨特切入點。隨著基因工程等技術的進步,干細胞療法和基因療法等創新療法也備受關注,為ALS的治療帶來了新的希望。
此外,對ALS癥狀的有效管理,對于改善患者的日常生活至關重要。近日,期刊《Frontiers in Neurology》發表了一篇題為“肌萎縮側索硬化癥的當前和新興治療策略:從藥物治療到基因和干細胞療法”的研究綜述,旨在對這一快速發展領域進行重點梳理[1]。
該綜述總結了已獲批及新興藥物治療的機制、療效與局限性;分析了干細胞與基因治療的原理、當前進展與挑戰,并特別強調了針對散發性ALS進行治療的必要性;最后,文章也突出了綜合癥狀管理在患者照護中不可或缺的作用。
藥物治療肌萎縮側索硬化癥的進展
肌萎縮側索硬化癥(ALS)藥物治療領域的進展已催生出一些疾病修飾療法。目前,包括利魯唑、依達拉奉和AMX0035在內的三種藥物已獲得FDA批準(表1)。值得注意的是,AMX0035的III期PHOENIX試驗結果并不理想,生產商已啟動市場撤回程序。此外,Tofersen已獲得加速批準,但仍需在正在進行的試驗中進一步證實其臨床療效。鑒于現有指南尚未納入Tofersen等最新獲批藥物,因此,根據患者個體情況定制治療方案至關重要。
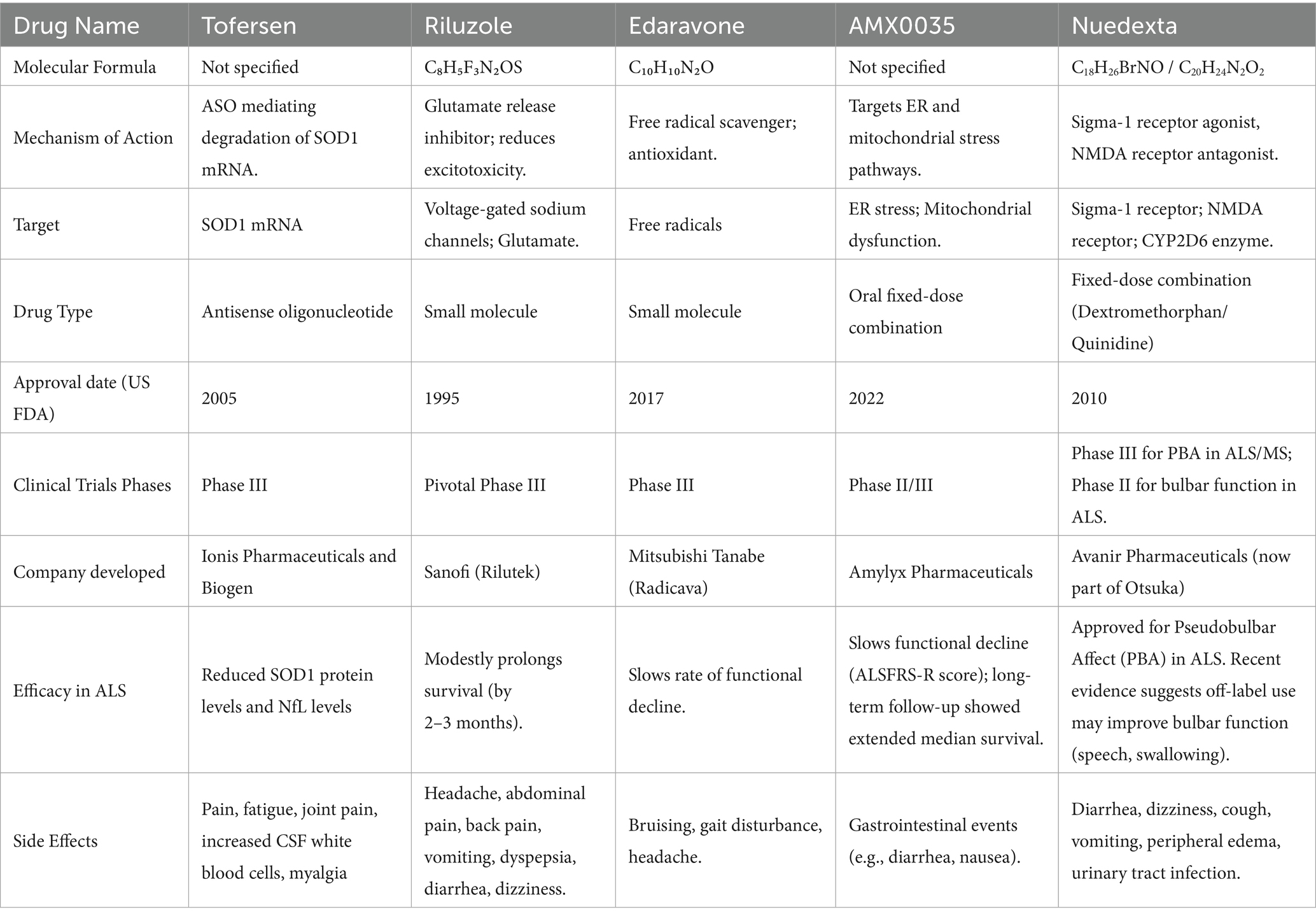
利魯唑:經典藥物,通過調節谷氨酸與抑制興奮性毒性實現有限的生存獲益
利魯唑是首個獲批的ALS基礎治療藥物,利魯唑的化學結構和主要特征如圖1所示。其核心作用機制在于調節谷氨酸穩態以對抗興奮性毒性。它通過阻斷電壓門控鈉通道減少谷氨酸釋放,并促進其攝取,從而降低細胞外谷氨酸水平,保護神經元。
此外,它也對鈣穩態、氧化應激和細胞凋亡途徑有調節作用。臨床試驗證實,該藥可延長患者中位生存期約2至3個月,并延緩呼吸功能衰退,但其臨床獲益有限。真實世界療效證據存在爭議,且使用時需密切監測肝功能等潛在不良反應。
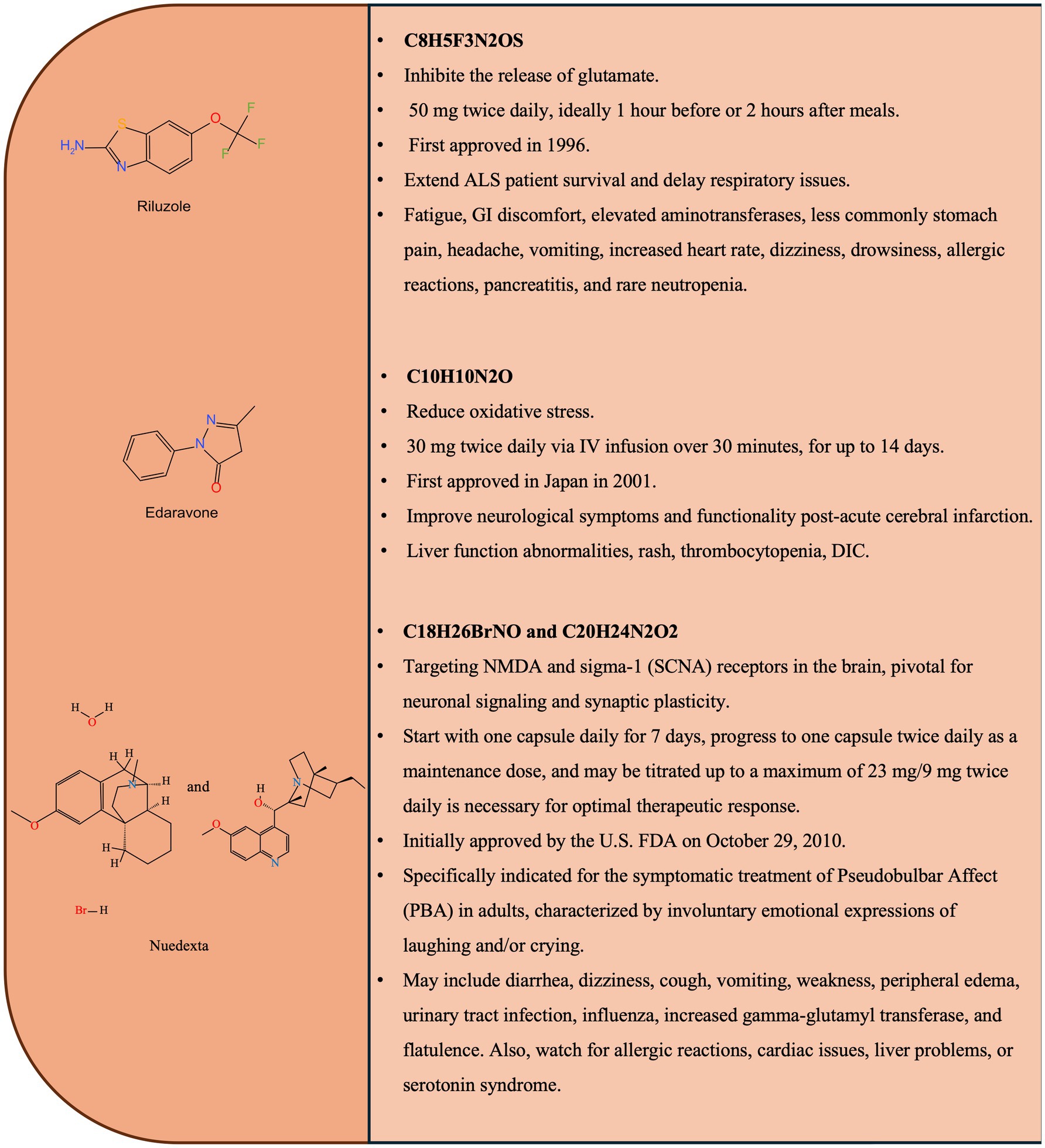
依達拉奉:以抗氧化應激為核心機制,其療效證據存在顯著的地域性差異
依達拉奉是一種自由基清除劑,其治療ALS的主要機制是通過強大的抗氧化活性,抑制脂質過氧化并清除羥自由基等有害活性氧,從而減輕氧化應激導致的神經元損傷。它在日本和美國獲批用于治療,尤其是早期ALS患者。
然而,其療效證據并不一致:關鍵臨床試驗顯示其能延緩功能下降,但部分真實世界研究(特別是來自印度的報告)未能證實其對功能評分或生存率的顯著改善。這種差異可能與患者群體異質性有關,其全球適用性仍需進一步評估。
AMX0035:靶向雙通路的聯合療法,其早期積極療效信號未能在關鍵III期試驗中得到證實
AMX0035是由苯丁酸鈉和牛磺熊去氧膽酸組成的復方制劑,旨在通過同時緩解內質網應激和線粒體功能障礙這一雙通路策略來保護神經元。基于顯示其能延緩疾病進展和延長生存期的II期試驗結果,它曾獲得有條件批準。
然而,隨后的確證性III期臨床試驗未能達到延緩功能衰退的主要療效終點,這凸顯了在更廣泛患者群體中復制早期積極結果的挑戰。該藥物最終因此自愿撤市,但其研發歷程為ALS藥物開發提供了重要經驗。
Tofersen:針對SOD1突變的精準基因療法,開創了基于生物標志物改善的加速批準范式
Tofersen是一種反義寡核苷酸藥物,專門用于治療攜帶SOD1基因突變的ALS患者。其作用機制是精準靶向并與SOD1mRNA結合,導致其降解,從而從源頭上減少有毒SOD1蛋白的生成。
盡管關鍵III期臨床試驗在主要臨床功能終點上未顯示顯著差異,但該藥能顯著降低腦脊液SOD1蛋白和血漿神經絲輕鏈(神經元損傷的關鍵生物標志物)水平。基于這一確切的生物標志物效應,Tofersen于2023年獲得FDA加速批準,成為ALS精準治療和基于生物標志物審批的重要里程碑。
Nuedexta:主要用于治療假性延髓麻痹的復方制劑,其潛在的神經保護作用仍在探索中
Nuedexta是右美沙芬和奎尼丁的復方制劑,已獲批用于治療ALS等疾病相關的假性延髓麻痹(PBA),即無法控制的大笑或哭泣。其作用機制是通過右美沙芬調節與情緒相關的神經遞質傳遞(奎尼丁則用于提高右美沙芬的生物利用度),從而穩定情緒反應。
此外,右美沙芬對σ-1受體及谷氨酸興奮性毒性的潛在作用,使其可能具備一定的神經保護功能,并可能對延髓功能(如言語、吞咽)有支持作用,但這方面的治療前景仍在研究之中。
二、肌萎縮側索硬化癥潛在的治療靶點
研究人員正在深入探索一系列生物靶點,以對抗肌萎縮側索硬化癥(ALS)及相關神經退行性疾病,每個靶點都為治療干預提供了獨特的途徑。潛在治療肌萎縮側索硬化癥(ALS,俗稱“漸凍癥”)的靶點主要圍繞疾病的核心病理機制展開,可分為以下幾類:
- 興奮性毒性調控靶點:靶向離子通道(如鈉、鉀、鈣通道)和谷氨酸受體,旨在抑制谷氨酸的過度釋放或作用,從而減輕其對神經元的興奮性毒性損傷。
- 神經炎癥調控靶點:針對中樞神經系統內過度激活的免疫反應,重點是小膠質細胞的異常活化及相關促炎因子,以減輕炎癥對神經元的損害。
- 氧化應激平衡靶點:旨在增強內源性抗氧化防御系統,例如提升超氧化物歧化酶(SOD)、谷胱甘肽過氧化物酶(GPx)等酶的活性,以對抗過量的活性氧造成的神經元損傷。
- 蛋白質穩態與清除靶點:針對錯誤折疊蛋白(如TDP-43)在細胞質中的異常聚集,策略包括激活自噬-溶酶體通路以清除聚集體,或利用分子伴侶等質量控制因子促進蛋白質正確折疊。
- 神經營養因子支持靶點:通過基因治療或藥物手段,提高腦源性神經營養因子(BDNF)、膠質細胞系衍生神經營養因子(GDNF)等因子的水平,以增強神經元的存活能力和功能。
- 線粒體功能與代謝靶點:聚焦于改善線粒體功能失調和能量代謝異常,通過恢復能量供應和細胞代謝穩態來支持神經元生存。
- 廣泛病理過程的共性靶點:特別強調針對在超過95% ALS病例(包括散發性ALS)中出現的共同病理特征,其中TDP-43蛋白病是關鍵核心靶點。此外,持續的神經炎癥、氧化應激和線粒體功能障礙也被視為適用于廣大患者群體的重要干預節點。
綜上所述,當前的潛在治療靶點不僅包括針對特定致病蛋白(如SOD1、TDP-43)的精準干預,更著重于開發能廣泛調節上述共有病理過程的療法,這對治療占多數的散發性ALS患者尤為重要。
三、治療肌萎縮側索硬化癥的創新療法
01、干細胞療法治療肌萎縮側索硬化癥
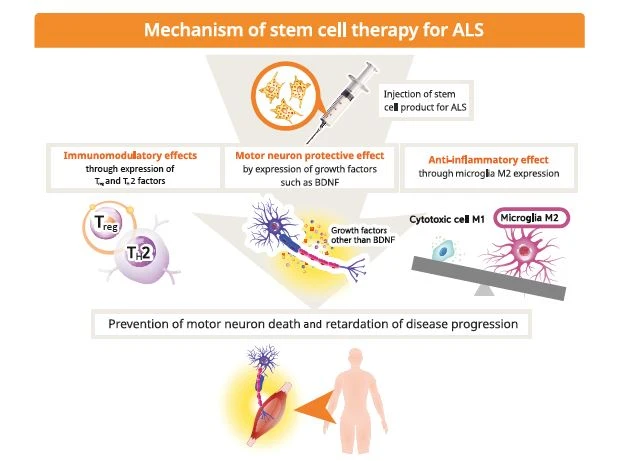
干細胞療法是治療肌萎縮側索硬化癥(ALS)的新興前沿領域,旨在提供神經保護、調節神經炎癥并有可能修復受損的運動神經元(圖2)。該策略利用多種細胞類型,包括間充質干細胞(MSCs)、神經干細胞(NSCs)和誘導多能干細胞(iPSCs)。
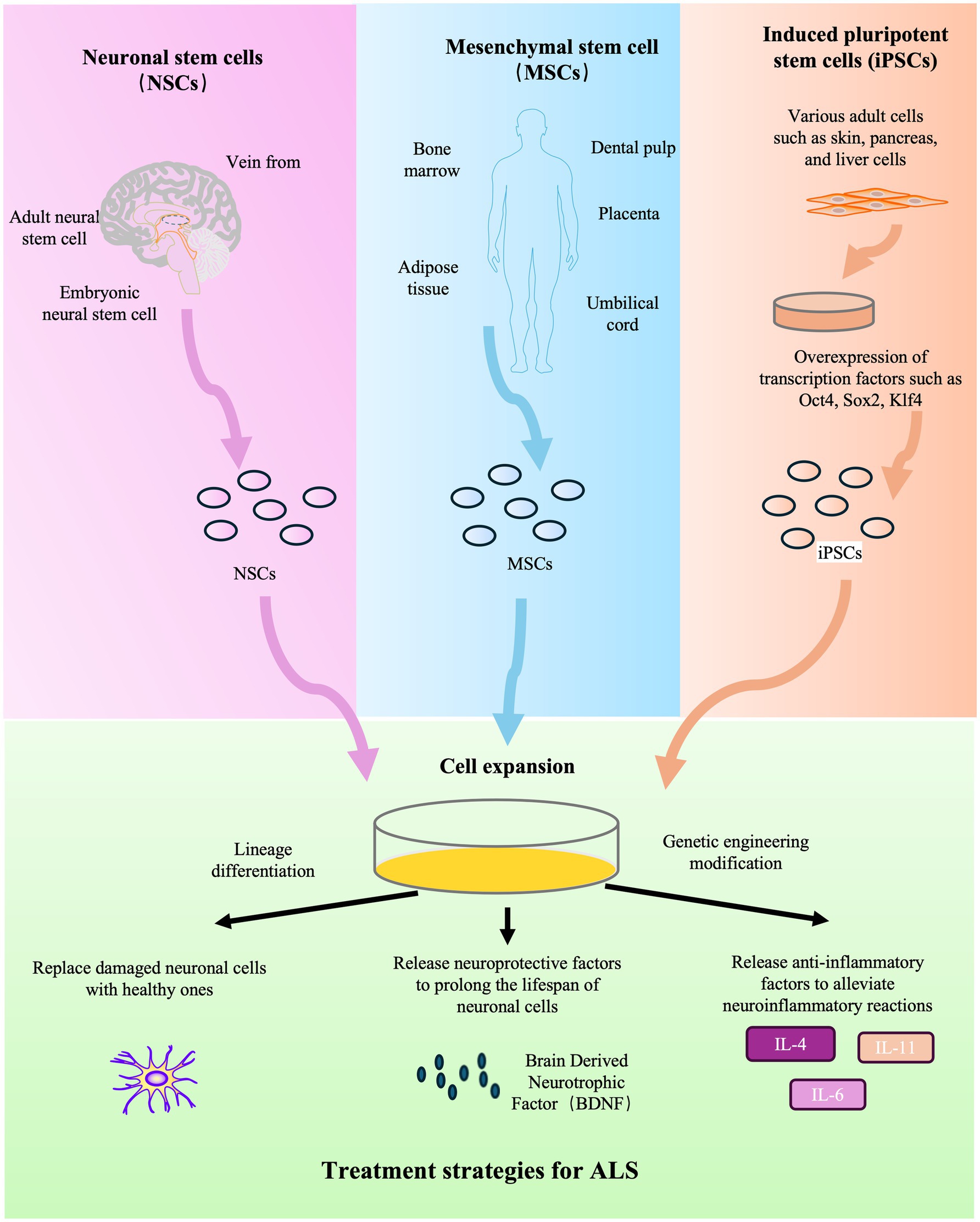
臨床前基礎和機制:動物模型研究已為該療法奠定了理論基礎。利用SOD1G93A轉基因小鼠等模型的研究表明,干細胞移植可以減輕神經炎癥并提供營養支持。例如,在這些模型中,間充質干細胞移植已被證明可以通過抑制有害免疫細胞的活化來調節神經炎癥環境。
此外,干細胞為遞送神經營養因子提供了一個平臺。例如,經基因工程改造、可分泌膠質細胞系衍生神經營養因子(GDNF)的神經祖細胞已在臨床前研究中得到探索。這些研究表明,益處可能不僅來自潛在的細胞替代,還源于強大的旁分泌效應。
然而,移植細胞在ALS微環境中長期存活和整合等挑戰,仍是臨床前模型面臨的重大障礙。生物材料與干細胞的結合也作為一種新方法在臨床前研究中被探索。除了直接治療,干細胞還被用于體外模擬ALS,從而深入揭示疾病機制并發現新的治療靶點。
干細胞治療漸凍癥的臨床轉化:試驗與挑戰:轉化到人體試驗已經歷了多個階段,早期研究主要評估安全性和可行性。
2021年,《肌肉與神經主頁》發表了一項“隨機、安慰劑對照的3期臨床研究,旨在評估間充質干細胞誘導分泌高水平神經營養因子治療肌萎縮側索硬化癥的效果[2]。

總體而言,MSC-NTF治療耐受性良好,未出現安全性問題。28周時,MSC-NTF組和安慰劑組分別有33%和28%的受試者達到臨床應答標準,因此未達到主要終點。對基線ALSFRS-R評分≥35的受試者(n=58)進行的預設分析顯示,28周時MSC-NTF組的臨床應答率為35%,安慰劑組為16%。MSC-NTF組在腦脊液中神經炎癥、神經退行性變和神經營養因子支持相關的生物標志物方面觀察到顯著改善,而安慰劑組未見變化。
2022年,一項將分泌GDNF的人類神經祖細胞移植到ALS患者脊髓中:一項1/2a期試驗表明,將分泌GDNF的人類神經祖細胞(CNS10-NPC-GDNF)移植到脊髓中,在42個月內是可行且安全的,并且未對運動功能產生負面影響[3]。

2025年9月18日,韓國CorestemChemon Inc.公司宣布它已在澳大利亞墨爾本舉行的PACTALS 2025大會上展示了Neuronata-R ? (lenzumestrocel) 第三階段ALSummit試驗的完整結果,用于治療漸凍癥 (ALS) [4]。
雖然整體試驗未能達到設定的主要和次要終點,但結果顯示:在疾病進展較慢的ALS患者中,Neuronata-R?展現出了顯著的療效。
并且該公司將在2026年前向美國食品藥品監督管理局(FDA)提交生物制品許可申請,縮短傳統臨床試驗周期,更快惠及患者。
這些臨床試驗正在認真評估各種干細胞類型和移植策略的安全性、可行性和有效性。臨床轉化面臨的常見挑戰包括免疫排斥、患者反應的個體差異以及對標準化細胞產品和遞送方案的需求。其對疾病進程和生存率的決定性影響仍有待研究,這凸顯了開展更多設計嚴謹的臨床研究的必要性。
02、肌萎縮側索硬化癥的基因治療
基因治療已成為ALS領域極具前景的方向,主要策略包括基因沉默、基因編輯及神經營養因子遞送(圖3)。
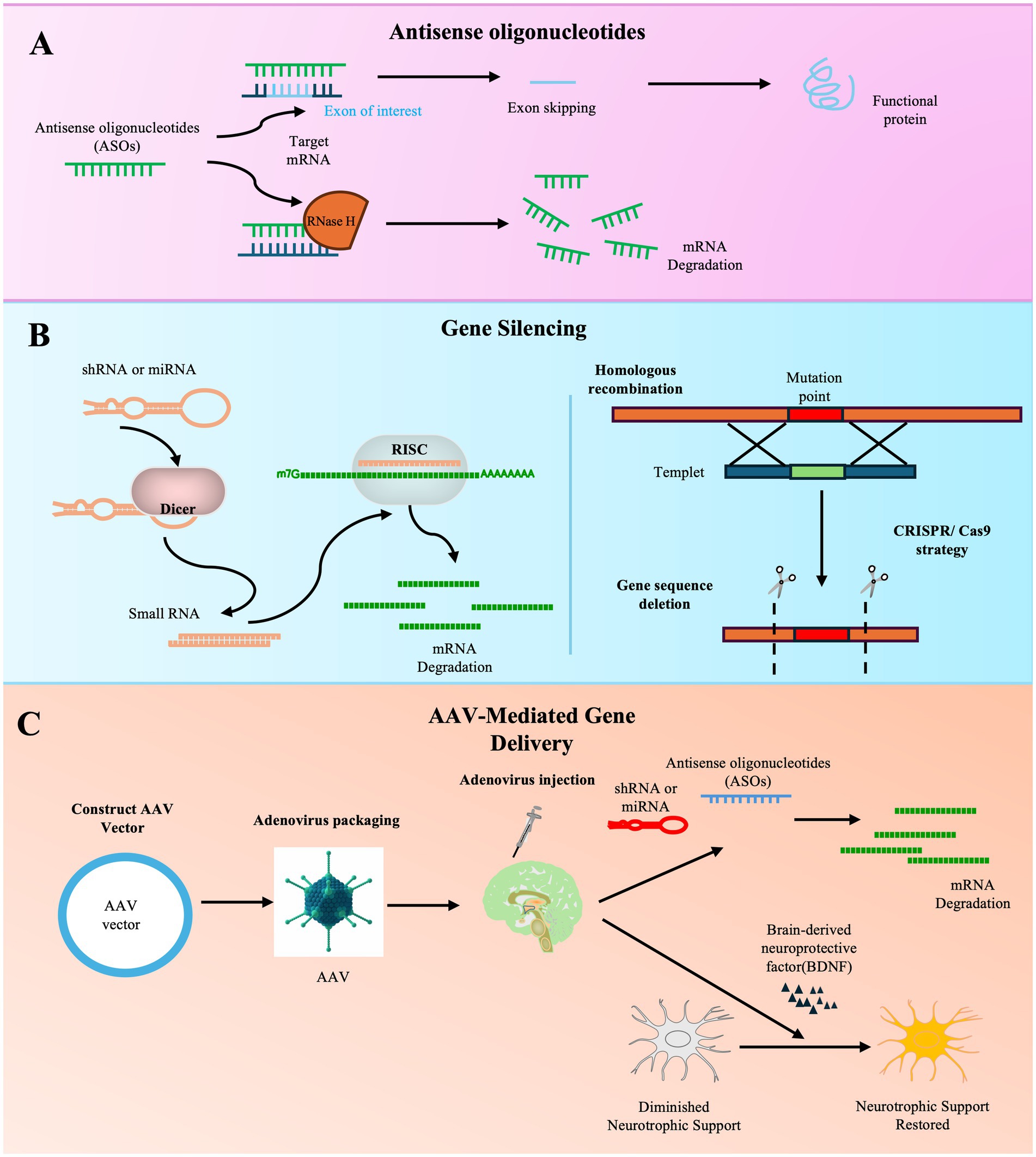
反義寡核苷酸療法的進展:針對SOD1的托弗森是ASO療法的代表,其基于生物標志物改善獲加速批準,標志著重要突破。目前,針對C9orf72、FUS、ATXN2等其他基因靶點的ASO候選藥物也正處于多項臨床試驗階段,顯示出該策略在遺傳型ALS中的持續拓展。
AAV載體遞送與其他策略:腺相關病毒載體介導的基因遞送在臨床前研究中取得進展。例如,通過脊髓軟膜下注射AAV9可實現廣泛的中樞神經系統基因沉默,在ALS動物模型中有效延緩運動神經元退化。同時,針對散發性ALS常見下游病理(如TDP-43蛋白異常)的基因調控策略正在探索,例如校正TDP-43依賴性STMN2剪接異常的ASO在臨床前模型中展現出潛力。此外,AAV遞送神經營養因子等支持性療法也為運動神經元存活提供了新思路。
挑戰與未來方向:基因治療仍面臨多重挑戰,包括遞送系統對中樞神經系統的覆蓋效率、基因編輯的精準度與脫靶風險控制。根本性難題在于,約占病例90%的散發性ALS缺乏明確單基因靶點,使得患者分層困難,療法開發需兼顧多病理通路。未來可能需要通過多靶點協同治療策略,并結合個體化醫療手段,方有望將ALS轉變為可控的慢性疾病。
四、肌萎縮側索硬化癥的癥狀管理
ALS的癥狀管理對于直接提升患者生活質量和心理福祉具有核心價值。疾病不僅導致運動功能喪失,還常伴隨情緒波動、抑郁焦慮、肌肉抽搐、疼痛、疲勞、睡眠障礙、流涎及便秘等廣泛的身心癥狀。盡管許多對癥藥物缺乏強效證據,但積極管理能顯著緩解患者痛苦,是全程照護中與疾病修飾療法同等重要的支柱。
管理的關鍵尤其體現在對呼吸衰竭和營養衰竭這兩個核心問題的干預上。臨床試驗證實,無創通氣不僅能平均延長生存期,更是改善生活質量的關鍵。同時,針對吞咽困難(及時啟動腸內營養)及肌肉痙攣(常用藥物如巴氯芬)的有效管理,直接關系到患者的生存安全與身體機能。這些個體化的支持性治療旨在動態響應患者需求,根本目標是在疾病各階段最大化其生活質量,并為照護者提供支持,實現富有同理心的整體護理。
五、討論與結論
眾多綜述已概述了ALS的病理生理與治療進展。本綜述的獨特價值在于,及時且批判性地分析了該領域近年的范式轉變(結合2023-2025年發展)。
這一轉變體現為“雙重戰略”框架的構建:一方面,是以Tofersen為代表的、基于生物標志物的精準基因沉默療法,為特定遺傳亞型帶來突破;另一方面,是針對缺乏明確基因靶點的絕大多數散發性患者,轉向開發調節TDP-43蛋白病、神經炎癥等共通下游病理的廣譜機制療法。
干細胞療法則被定位為該框架中的重要探索方向,認可其在臨床前研究中展現的神經保護與免疫調節潛力,但也指出了其面臨的細胞存活、整合及長期安全性等挑戰。
通過對Tofersen的加速批準、AMX0035的III期失敗以及細胞療法的前景與難題進行并置分析,本文清晰地勾勒出當前療法從研發到臨床轉化的復雜全景。討論尖銳地指出,Tofersen的成功反而凸顯了約90%散發性ALS患者的“靶點困境”。
因此,未來的“精準性”必須超越單一基因靶向,邁向基于生物標志物的病理分型。在此背景下,基于機制的藥物與干細胞療法扮演互補角色:前者精確調控特定異常通路,后者則可能提供廣泛的支持性微環境。兩者的成功應用都極度依賴于生物標志物的進步,以實現對高度異質患者群體的有效分層。
最終,本文構建了一個基因療法、細胞療法、藥物療法與支持護理深度融合的未來協同框架:
- 精準打擊:對明確遺傳亞型使用基因沉默或編輯療法。
- 環境重塑與系統支持:對散發型患者,探索將調節特定通路的靶向藥物與具有廣譜支持作用的細胞療法相結合。
- 全程基石:所有疾病修飾療法都必須與全方位的支持性護理深度整合,以直接改善生活質量和生存結局。
盡管挑戰巨大,但通過生物標志物指導的患者分層,并靈活組合基因工具、細胞載體、藥物分子及支持護理,這一綜合策略旨在將ALS逐步轉變為一種可管理的慢性疾病。細胞療法在其中扮演著不可替代的“環境調節者”和“系統支持者”角色,是填補當前治療空白的關鍵探索方向。
參考資料:
[1]:Wang Z, Huang J and Yun D (2026) Current and emerging therapeutic strategies for amyotrophic lateral sclerosis: from pharmacological approaches to gene and stem cell therapies. Front. Neurol. 17:1729302. doi: 10.3389/fneur.2026.1729302
[2]:https://onlinelibrary.wiley.com/doi/10.1002/mus.27472
[3]:https://www.nature.com/articles/s41591-022-01956-3
[4]:https://www.nature.com/articles/d43747-020-00727-8
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加官方微信
掃碼添加官方微信