近年來,急性和慢性肺部疾病的發(fā)病率和死亡率持續(xù)攀升,已成為全球性公共衛(wèi)生負(fù)擔(dān)。然而,現(xiàn)代醫(yī)學(xué)對炎癥相關(guān)肺部疾病的治療方法仍存在局限,緩解病情并實現(xiàn)肺組織再生修復(fù)成為亟待解決的關(guān)鍵科學(xué)問題。
間充質(zhì)干細(xì)胞(MSCs)憑借其抗炎、抗凋亡及促進(jìn)組織再生的能力,已被廣泛應(yīng)用于多種炎癥性疾病的治療研究。基于MSC的療法在再生醫(yī)學(xué)領(lǐng)域日益受到重視,顯示出作為肺部疾病理想治療策略的潛力。在肺損傷動物模型中,MSCs表現(xiàn)出顯著的組織修復(fù)效果,其機(jī)制涵蓋減輕肺泡上皮與內(nèi)皮細(xì)胞炎癥、降低通透性、增強(qiáng)肺泡液體清除能力以及抑制氧化應(yīng)激等多個方面。
MSCs被廣泛研究的一個重要原因在于其強(qiáng)大的免疫調(diào)節(jié)功能,能夠通過調(diào)控先天性與適應(yīng)性免疫反應(yīng)中多種免疫細(xì)胞的行為發(fā)揮作用。越來越多的證據(jù)表明,MSCs可通過調(diào)節(jié)中性粒細(xì)胞、巨噬細(xì)胞、T細(xì)胞和B細(xì)胞等免疫細(xì)胞,顯著緩解多種肺部疾病的病理進(jìn)程。
近日,浙江中醫(yī)藥大學(xué)附屬第一醫(yī)院(浙江省中醫(yī)院多個科室在《Nature》上發(fā)表題為“Mesenchymal stem cells for lung diseases: focus on immunomodulatory action”的綜述文章,系統(tǒng)回顧了間充質(zhì)干細(xì)胞通過免疫細(xì)胞調(diào)控緩解肺部疾病的證據(jù)[1]。

該文從MSCs的免疫調(diào)節(jié)特性出發(fā),總結(jié)了其在先天性與適應(yīng)性免疫中的具體作用機(jī)制,并探討了MSCs在三大肺部疾病治療中的臨床研究進(jìn)展。
間充質(zhì)干細(xì)胞對肺部疾病期間先天免疫反應(yīng)的影響
中性粒細(xì)胞
中性粒細(xì)胞的激活與募集在急性肺損傷(ALI)的病理機(jī)制中起到關(guān)鍵作用。在急性炎癥過程中,中性粒細(xì)胞通過多步驟募集級聯(lián)迅速從血液遷移至炎癥部位,是最早到達(dá)損傷區(qū)域的免疫細(xì)胞。盡管中性粒細(xì)胞在宿主防御和清除細(xì)胞碎片中具有重要作用,其過度活化卻會釋放大量毒性物質(zhì),包括活性氧(ROS)、促炎細(xì)胞因子(如NF-κB、IL-1β、IL-17)及蛋白酶,進(jìn)一步放大炎癥反應(yīng)并導(dǎo)致組織損傷。因此,靶向中性粒細(xì)胞已成為ALI治療的新策略。
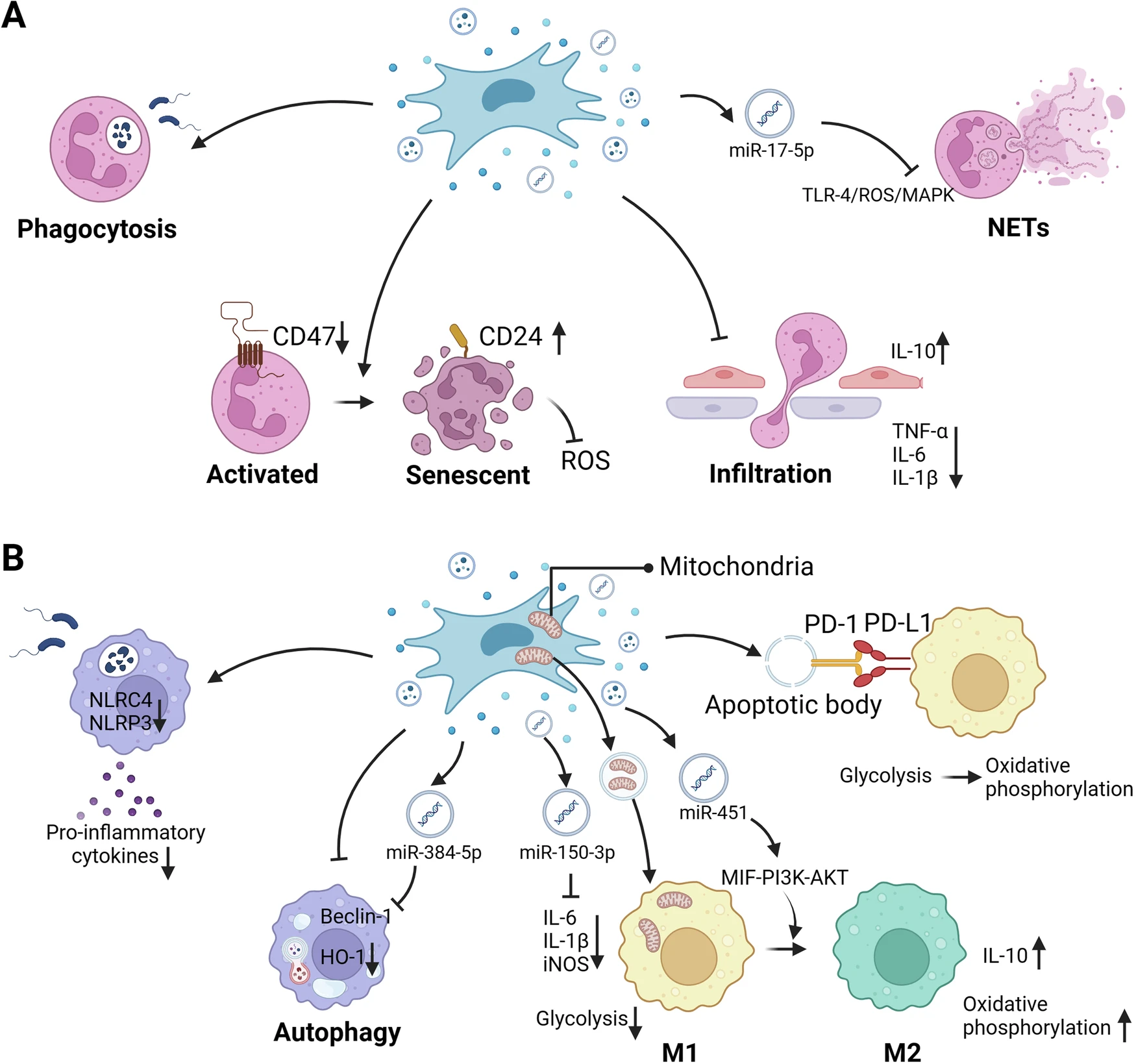
多項研究表明,MSCs能夠多方面調(diào)控中性粒細(xì)胞反應(yīng):抑制其遷移與浸潤,降低ROS及炎癥因子的釋放,并通過上調(diào)CD24表達(dá)促使活化的中性粒細(xì)胞向衰老類型轉(zhuǎn)化,從而緩解氧化應(yīng)激與組織損傷。此外,MSCs及其外泌體還可通過抑制中性粒細(xì)胞胞外陷阱(NET)的形成,阻斷TLR-4/ROS/MAPK信號通路,避免炎癥反應(yīng)的進(jìn)一步加劇。
巨噬細(xì)胞
肺組織中的巨噬細(xì)胞在炎癥反應(yīng)中起著核心作用。多項臨床前研究表明,MSCs及其分泌因子可以通過靶向巨噬細(xì)胞來修復(fù)肺組織損傷(表1、圖1B)。MSCs及其胞外囊泡可以減少巨噬細(xì)胞的浸潤,降低巨噬細(xì)胞中促炎細(xì)胞因子的水平,提高抗炎因子的水平,并提高其吞噬功能,最終改善肺組織損傷。
嗜酸性粒細(xì)胞
哮喘是一種慢性炎癥性氣道疾病,嗜酸性粒細(xì)胞在其中發(fā)揮著重要作用。嗜酸性粒細(xì)胞是參與過敏性疾病的末端效應(yīng)細(xì)胞。在接收到刺激信號后,嗜酸性粒細(xì)胞通過釋放各種免疫調(diào)節(jié)因子(如細(xì)胞因子、趨化因子、生長因子和細(xì)胞毒性蛋白)發(fā)揮免疫調(diào)節(jié)和促炎功能。
多項研究表明,MSCs同樣展現(xiàn)出免疫調(diào)節(jié)作用。它們不僅能降低氣道內(nèi)嗜酸性粒細(xì)胞數(shù)量,緩解過敏性炎癥和氣道重塑,還可通過外泌體遞送miR-146a-5p抑制ILC2活化,減少嗜酸性粒細(xì)胞持續(xù)性增多。
綜上,MSCs通過多靶點、多機(jī)制干預(yù)先天免疫細(xì)胞功能,有效緩解肺部疾病的炎癥反應(yīng)和組織損傷。
MSCs對肺部疾病期間適應(yīng)性免疫反應(yīng)的影響
T細(xì)胞
CD4?T細(xì)胞是適應(yīng)性免疫反應(yīng)中的主要細(xì)胞,在機(jī)體發(fā)育與穩(wěn)態(tài)維持中發(fā)揮重要作用。
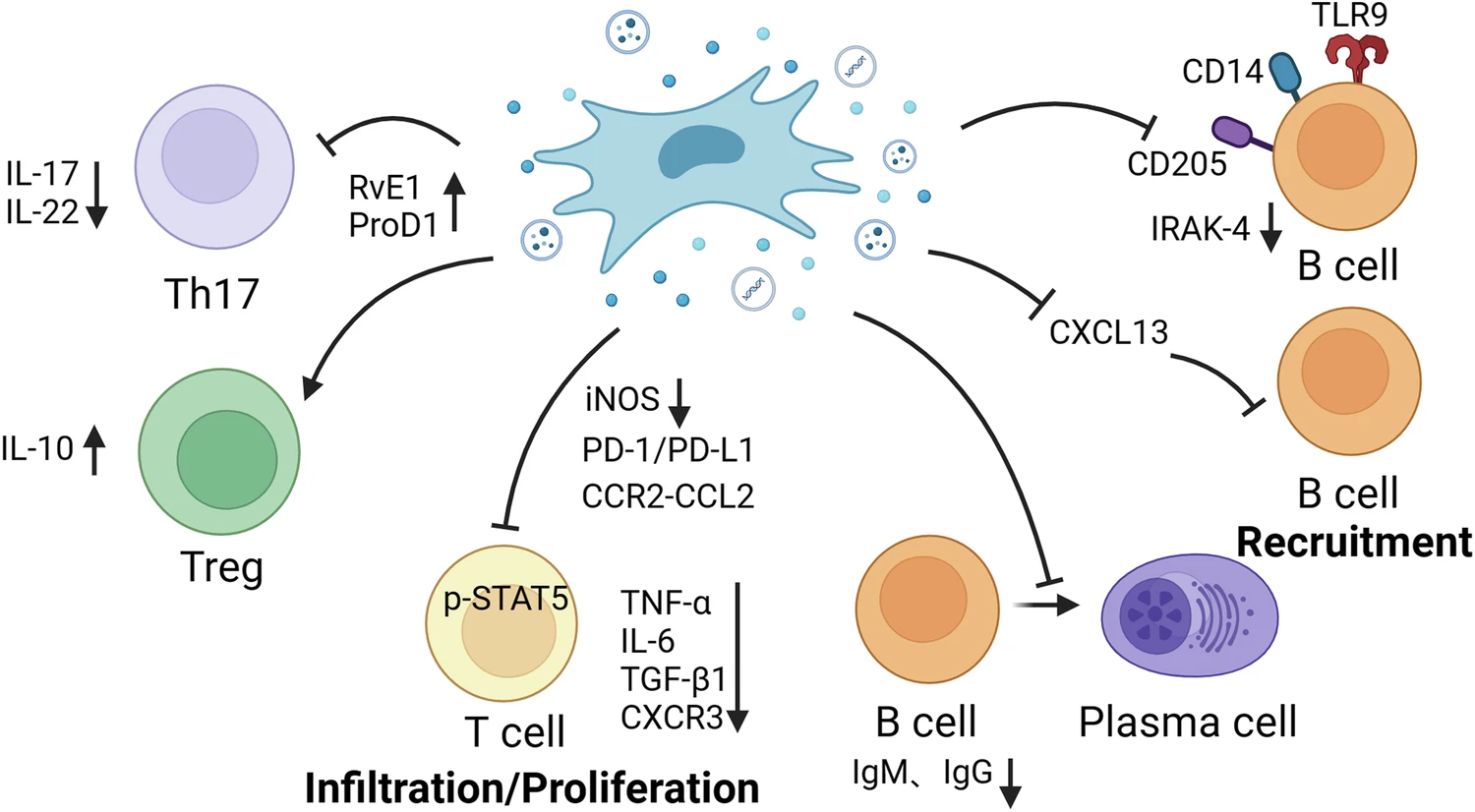
在肺部疾病中,MSCs通過調(diào)控CD4?T細(xì)胞亞群平衡 來緩解炎癥和組織損傷。Tregs具有抗炎和促進(jìn)修復(fù)的作用,而Th17細(xì)胞則通過分泌IL-17加劇炎癥和組織損害。MSCs能抑制初始CD4?T細(xì)胞向Th17分化,減少IL-17、IL-22的產(chǎn)生,同時誘導(dǎo)Tregs增加,提升IL-10、Foxp3表達(dá),從而恢復(fù)Th17/Treg平衡,促進(jìn)肺泡上皮修復(fù)并減輕肺損傷。
此外,MSCs還能作用于CD8?T細(xì)胞和CD3?T細(xì)胞,通過PD-1/PD-L1通路抑制其浸潤和促炎因子釋放,從而減輕纖維化并改善肺功能。同時,MSC治療降低CXCR3表達(dá),減少CD8?T細(xì)胞趨化和中性粒細(xì)胞浸潤,進(jìn)而緩解炎癥反應(yīng)。研究顯示,MSCs移植不僅能改善急性肺損傷,還能減輕博來霉素或百草枯誘導(dǎo)的肺纖維化,體現(xiàn)出其在調(diào)控適應(yīng)性免疫反應(yīng)中的多重保護(hù)作用(表2、圖2)。
B細(xì)胞
B細(xì)胞在適應(yīng)性免疫反應(yīng)中既能作為抗原提呈細(xì)胞,又能分泌多種細(xì)胞因子,并分化為抗體分泌的漿細(xì)胞。其在呼吸系統(tǒng)疾病中的浸潤和IgM、IgG、IgE等免疫球蛋白的產(chǎn)生與疾病嚴(yán)重程度密切相關(guān)。研究表明,MSCs能抑制B細(xì)胞的增殖與漿細(xì)胞分化,減少免疫球蛋白的生成,并下調(diào)相關(guān)基因(如Iglc2、Iglc3、Ighd)的表達(dá),從而減輕炎癥和肺損傷。
此外,MSCs還能通過調(diào)控B細(xì)胞相關(guān)趨化因子的表達(dá)影響免疫反應(yīng)。例如,MSCs可抑制ALI小鼠中B細(xì)胞分泌CCL4,減少中性粒細(xì)胞的募集;胎膜來源MSCs(HAMSCs)則通過抑制CXCL13干預(yù)肺纖維化中B細(xì)胞的募集與歸巢。
同時,MSCs還能降低CpG誘導(dǎo)的B細(xì)胞傳感器(CD205、TLR9、CD14)的表達(dá),抑制下游炎癥信號通路,進(jìn)一步發(fā)揮免疫調(diào)節(jié)和抗炎作用。
干細(xì)胞治療3大肺部疾病的臨床試驗
01、干細(xì)胞治療慢阻肺疾病的臨床研究
2024年,吉美瑞生超級器官研發(fā)中心首席科學(xué)家、同濟(jì)大學(xué)醫(yī)學(xué)院/附屬東方醫(yī)院左為教授與廣州醫(yī)科大學(xué)附屬第一醫(yī)院鐘南山院士、李時悅教授團(tuán)隊及陸軍軍醫(yī)大學(xué)附屬西南醫(yī)院戴曉天教授合作在《Science》子刊《Science Translational Medicine》期刊發(fā)表了題為“Autologous transplantation of P63+ lung progenitor cells for chronic obstructive pulmonary disease therapy”(移植自體P63陽性肺前體細(xì)胞用于慢性阻塞性肺病的治療)的研究論文[2]。

研究表明,經(jīng)氣道基底層干細(xì)胞治療后,超過70%的慢阻肺病患者的肺換氣功能顯著改善、運動能力提升。此外,長期隨訪顯示,慢阻肺病患者生存期在治療后明顯延長,最早的患者目前已隨訪到治療后第9年。該論文是第一個正式發(fā)表的基于肺臟再生機(jī)理的細(xì)胞治療臨床試驗,證實了氣道基底層干細(xì)胞移植能夠顯著提升患者的肺換氣功能,實現(xiàn)肺功能的逆轉(zhuǎn)與再生修復(fù)。
2025年3月24日,首例慢阻肺病患者在上海交通大學(xué)醫(yī)學(xué)院附屬瑞金醫(yī)院海南醫(yī)院順利完成了干細(xì)胞治療,由周敏教授完成支氣管鏡給藥操作[3]。
該患者因慢性阻塞性肺疾病長期活動受限,經(jīng)推薦接受自體氣道基底層干細(xì)胞移植治療。該療法由左為教授團(tuán)隊基于R-Clone專利技術(shù)自主研發(fā),治療過程包括:從患者氣道健康區(qū)域提取成體干細(xì)胞,體外擴(kuò)增約1個月后,通過支氣管鏡精準(zhǔn)回輸至肺部受損區(qū)域。該技術(shù)安全、簡便,僅需一次治療,便能帶來長期療效。
02、干細(xì)胞治療哮喘的臨床研究
2025年6月,《Medicine》報道一例54歲女性患者,在接受Regentime干細(xì)胞療法后,不僅踝關(guān)節(jié)骨關(guān)節(jié)炎癥狀改善,哮喘也獲臨床緩解。該患者通過吸入途徑接受干細(xì)胞治療,喘息與呼吸困難癥狀在治療后一個月消失,并維持緩解超過24個月[4]。

03、干細(xì)胞治療肺纖維化的臨床研究
2025年1月,由上海交通大學(xué)醫(yī)學(xué)院附屬第六人民醫(yī)院、浙江大學(xué)醫(yī)學(xué)院附屬第一醫(yī)院、蘇州大學(xué)生物與基礎(chǔ)醫(yī)學(xué)學(xué)院等多個單位聯(lián)合完成的研究,首次在臨床上應(yīng)用小氣道自體干細(xì)胞移植治療難治性IPF,取得了顯著突破,并在國際頂級醫(yī)學(xué)期刊《柳葉刀》子刊《eBioMedicine》上發(fā)表[5]。

自體基底細(xì)胞移植顯著改善肺功能:這項研究以三名晚期特發(fā)性肺纖維化(IPF)患者為對象,利用支氣管鏡獲取其小氣道基底細(xì)胞(BC),在體外擴(kuò)增后再回輸至患者體內(nèi)。
結(jié)果顯示,所有患者在治療后肺功能均有顯著改善,特別是在肺活量(FVC)和小氣道功能方面表現(xiàn)突出。治療24周后,三位患者的FVC分別由42.2%、53.3%和42.5%提升至50.5%、70%和52.7%。值得注意的是,彌散能力(DLCO)在回輸24小時后即明顯上升,并能長期維持。
在小氣道功能方面,患者的50%呼氣流量(FEF50)和最大呼氣流量(PEF)等指標(biāo)均有明顯提升。CT影像學(xué)結(jié)果進(jìn)一步證實了療效:肺容量增加、肺密度降低,炎癥反應(yīng)及過度沉積的細(xì)胞外基質(zhì)被吸收,間質(zhì)纖維化明顯緩解。整體來看,基底細(xì)胞移植有效改善了肺通氣和彌散功能,為晚期IPF的治療提供了新的思路。
這項研究的意義:研究提出了一種用于IPF管理的新型細(xì)胞治療方法,強(qiáng)調(diào)了進(jìn)一步研究近端和遠(yuǎn)端BC在IPF進(jìn)展中的具體特征的必要性。從近端氣道分離的功能性BC能夠增強(qiáng)IPF患者的肺功能,這表明它們有可能成為一種有效的治療選擇,并可能引發(fā)IPF治療的范式轉(zhuǎn)變。這項研究提供了基礎(chǔ)數(shù)據(jù),支持未來開展更大規(guī)模臨床試驗的需求。
結(jié)論
肺部疾病目前仍缺乏有效的治療方法,研究人員正在努力尋找新的有效藥物。
MSC及其衍生的分泌蛋白組對肺部疾病具有保護(hù)作用,提示可能是一種潛在的治療方法。免疫細(xì)胞在肺部疾病的進(jìn)展中起著至關(guān)重要的作用。MSC具有免疫調(diào)節(jié)特性,可以作用于中性粒細(xì)胞、巨噬細(xì)胞、T細(xì)胞和B細(xì)胞,并在肺部疾病期間的先天性和適應(yīng)性免疫反應(yīng)中發(fā)揮作用。
然而,MSC及其分泌蛋白組在臨床應(yīng)用中面臨諸多挑戰(zhàn),例如異質(zhì)性、體內(nèi)轉(zhuǎn)化不安全、存活率低以及缺乏標(biāo)準(zhǔn)化的胞外囊泡分離、提取和儲存方法。未來需要開展更全面的基礎(chǔ)研究和更大規(guī)模的臨床試驗來解決這些問題。
參考資料:
[1]:Feng, Y., Lu, J., Jiang, J. et al. Mesenchymal stem cells for lung diseases: focus on immunomodulatory action. Cell Death Discov. 11, 52 (2025). https://doi.org/10.1038/s41420-025-02303-4
[2]:https://www.science.org/doi/10.1126/scitranslmed.adi3360
[3]:肺干細(xì)胞治療前沿技術(shù)落地!上海交大瑞金醫(yī)院(海南醫(yī)院)正式啟用氣道基底層干細(xì)胞治療慢阻肺病新技術(shù)
[4]:Boulos RT, Najjoum CF, Mansour VJ, El Asmar EA, Abi Chahine NH. The Regentime stem cell procedure efficacy in asthma treatment: A case report. Medicine (Baltimore). 2025 Jun 13;104(24):e42887. doi: 10.1097/MD.0000000000042887. PMID: 40527844; PMCID: PMC12173279.
[5]:https://www.thelancet.com/journals/ebiom/article/PIIS2352-3964(24)00574-7/fulltext
免責(zé)說明:本文僅用于傳播科普知識,分享行業(yè)觀點,不構(gòu)成任何臨床診斷建議!杭吉干細(xì)胞所發(fā)布的信息不能替代醫(yī)生或藥劑師的專業(yè)建議。如有版權(quán)等疑問,請隨時聯(lián)系我。



 掃碼添加官方微信
掃碼添加官方微信