引言:神經(jīng)退行性疾病的困境與干細胞治療的曙光
神經(jīng)退行性疾病——包括阿爾茨海默病(AD)、帕金森病(PD)、肌萎縮側索硬化(ALS)等——以神經(jīng)元進行性喪失為共同特征,導致認知、運動功能的不可逆損傷。隨著全球老齡化加劇,此類疾病負擔日益沉重。以帕金森病為例,全球患者預計2040年將突破1400萬。然而,傳統(tǒng)治療(如AD的膽堿酯酶抑制劑、PD的左旋多巴)僅能暫時緩解癥狀,無法阻斷神經(jīng)元的持續(xù)死亡或實現(xiàn)組織再生,疾病修飾療法(DMTs)的缺失成為臨床最大痛點。
干細胞治療神經(jīng)退行性疾病的干細胞類型都有哪些?
在這一背景下,干細胞治療憑借其“細胞替代”“神經(jīng)保護”與“微環(huán)境調控”三重機制,成為突破神經(jīng)修復瓶頸的新希望:
- 替代損傷細胞:分化為多巴胺能神經(jīng)元、運動神經(jīng)元等特定類型,直接填補神經(jīng)元缺失;
- 分泌營養(yǎng)因子:釋放膠質細胞源性神經(jīng)營養(yǎng)因子(GDNF)、腦源性神經(jīng)營養(yǎng)因子(BDNF)等,抑制凋亡、促進突觸重建;
- 調節(jié)免疫炎癥:重塑病變微環(huán)境,減輕神經(jīng)炎癥與氧化應激。
近年來,干細胞領域的技術迭代與臨床轉化加速推進。2025年《自然》期刊同期發(fā)表的兩項里程碑試驗證實,人誘導多能干細胞(iPSC)與人胚胎干細胞(hESC)衍生的多巴胺能前體細胞移植治療帕金森病,不僅安全性良好,且顯著提升患者運動功能,標志著干細胞治療從實驗室邁向臨床的關鍵跨越。
當前應用于神經(jīng)退行性治療的干細胞,已從早期的胚胎干細胞拓展至9大類型,各具獨特優(yōu)勢與挑戰(zhàn)。
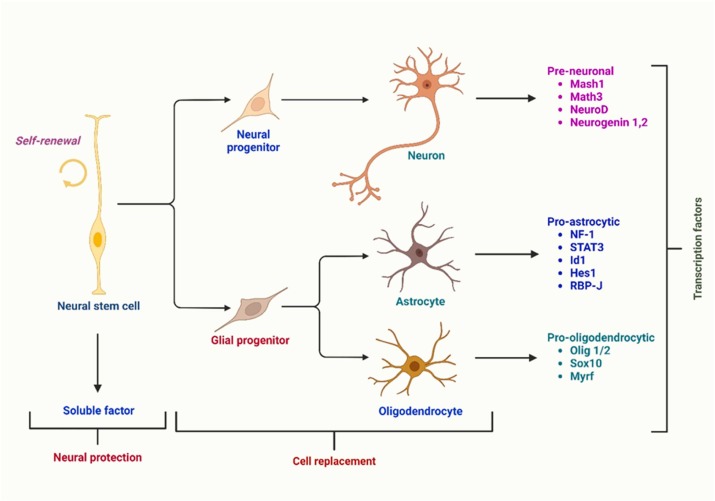
一、神經(jīng)干細胞(NSC)——多向分化的原位修復者
神經(jīng)干細胞主要存在于胎兒期(人9.5-12周胎腦),可分化為神經(jīng)元、星形膠質細胞和少突膠質細胞(圖1),其快速增殖特性賦予其治療潛力。在神經(jīng)退行性疾病模型中:
- 多發(fā)性硬化(MS):重建髓鞘并分泌修復性細胞因子;
- 脊髓損傷(SCI):雖不能直接修復損傷,但通過分泌神經(jīng)營養(yǎng)因子減輕炎癥;
- 漸凍癥(ALS):人NSC移植延緩SOD1大鼠發(fā)病并延長壽命;
- 腦缺血:遷移分化促進功能恢復。
核心機制:病理依賴性作用(替代損傷細胞或神經(jīng)保護)。
二、間充質干細胞(MSC)——免疫調控的支援者
MSC可從成體組織(脂肪/骨髓)及胎兒附屬物(臍帶血/胎盤)獲取,特征性表達 CD29/CD44/CD73/CD90/CD105,缺失免疫原性標志物(CD14/CD45/HLA-DR)。其局限性在于增殖分化能力隨傳代下降,且在神經(jīng)系統(tǒng)中主要發(fā)揮免疫調節(jié)而非細胞替代作用:
脊髓損傷:利用抗氧化和神經(jīng)營養(yǎng)特性部分保存組織、恢復運動功能。
MS/ALS:通過抑制神經(jīng)炎癥改善病程;
三、胚胎干細胞(ESC)——全能分化的奠基者
胚胎干細胞(ESC)的治療潛力與機制
ESC因其無限增殖能力(維持高端粒酶活性與正常細胞周期)和多向分化潛能,自20世紀80年代起成為神經(jīng)修復的核心工具。研究表明,ESC移植可有效改善神經(jīng)退行性疾病模型:
帕金森病(PD):移植至PD大鼠紋狀體的未分化小鼠ESC分化為多巴胺能神經(jīng)元,顯著改善運動功能;靈長類ESC在PD猴模型中亦生成酪氨酸羥化酶(TH?)神經(jīng)元并逆轉行為缺陷。
脊髓損傷(SCI):未分化ESC通過分泌營養(yǎng)因子減輕炎癥、保護髓鞘;而預分化為少突膠質前體細胞的ESC則直接促進軸突髓鞘再生。
腦缺血模型:視黃酸預處理的ESC移植增強神經(jīng)功能恢復。
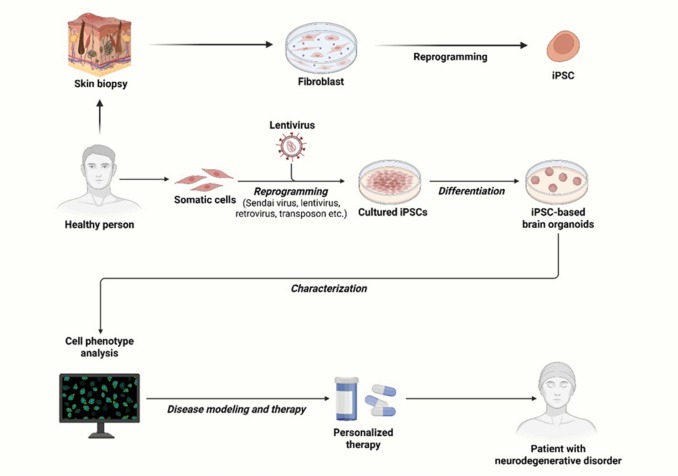
四、誘導多能干細胞(iPSC)——倫理困境的破局者
iPSC的技術突破與風險管控
iPSC通過重編程體細胞(引入Klf4/c-Myc/Sox2/Oct3/4)獲得類胚胎干細胞特性,規(guī)避了ESC的倫理爭議,但面臨致瘤性挑戰(zhàn):
治療效能:
- PD大鼠模型中,人iPSC分化的多巴胺能祖細胞成功整合入腦實質,改善運動功能(圖2);
- 脊髓損傷小鼠經(jīng)神經(jīng)譜系分化的iPSC移植后運動功能恢復;
- 腦缺血治療中,纖維蛋白膠支持的iPSC衍生神經(jīng)元/星形膠質細胞顯著縮小梗死面積、抑制炎癥。
風險控制:
- 熒光激活分選(FACS)可剔除巢蛋白(Nestin?)腫瘤樣細胞;
- 關鍵局限:iPSC衍生的DA神經(jīng)元成熟度低于ESC來源,且體內發(fā)育速度過快可能影響整合精度。
核心對比:ESC分化能力更強,但受限于倫理;iPSC支持個體化治療,需嚴格優(yōu)化分化方案與腫瘤風險監(jiān)控。
總結對比
| 干細胞類型 | 核心優(yōu)勢 | 神經(jīng)治療機制 | 主要局限 |
|---|---|---|---|
| NSC | 定向神經(jīng)分化 | 替代損傷細胞+神經(jīng)保護 | 來源有限 |
| MSC | 低免疫原性+易獲取 | 免疫調節(jié)+抗氧化 | 神經(jīng)分化能力弱 |
| ESC | 全能分化+高效增殖 | 細胞替代+營養(yǎng)支持 | 倫理爭議+致瘤性 |
| iPSC | 自體移植+無倫理沖突 | 個體化細胞替代 | 致瘤風險+分化效率不穩(wěn)定 |
五、臍帶血干細胞(UCB-SC)的特性與應用
臍帶血干細胞具有低免疫原性、易獲取且成本低廉的優(yōu)勢,其成分包含約1%的未成熟淋巴細胞與單核細胞(具內皮/造血祖細胞標志),可雙向分化為造血及非造血細胞。雖臍帶血來源的間充質干細胞(MSC)增殖能力強,但分化譜系受限(如難成脂細胞);而其中CD34?內皮祖細胞能促進神經(jīng)發(fā)生與血管生成,甚至輔助胚胎干細胞形成。因其可向神經(jīng)膠質/神經(jīng)元樣細胞分化,被視為神經(jīng)退行性疾病(ND)的潛在療法。
六、神經(jīng)祖細胞(NP)的內源性修復潛力
神經(jīng)祖細胞存在于腦室生發(fā)層,具有增殖及定向分化為特定神經(jīng)細胞的能力。成年哺乳動物(嚙齒類、靈長類及人類)腦室的星形膠質細胞可轉化為NP細胞,提示內源性神經(jīng)修復可能。然而,NP細胞的遷移與整合能力受物種和細胞系差異影響,導致其移植效果不穩(wěn)定,這限制了其在再生醫(yī)學中的標準化應用。
七、子宮內膜再生細胞(ERC)的安全性與多能性
子宮內膜再生細胞屬間充質樣干細胞,可從經(jīng)血中非侵入性提取,具有高效增殖能力且無致瘤風險。其核心優(yōu)勢在于:
- 跨胚層分化潛能(內/中/外胚層組織);
- 強免疫調節(jié)特性,支持同種異體移植;
- 在肢體缺血及心梗模型中證實治療效益,為神經(jīng)修復提供新型細胞來源。
八、造血干細胞(HSC)的發(fā)育機制與神經(jīng)關聯(lián)
造血干細胞經(jīng)歷多階段胚胎發(fā)育:中胚層前體需在特定微環(huán)境中完成自我更新與成熟,形成功能性HSC池。體外擴增HSC需精準模擬其發(fā)育微環(huán)境。外周血與骨髓中的循環(huán)HSC可能通過調節(jié)免疫反應參與神經(jīng)退行性疾病(尤其伴自身免疫機制者),但其分化為神經(jīng)細胞的能力尚未明確,現(xiàn)階段臨床價值集中于免疫調控領域。
九、脂肪來源干細胞(ADSC)的技術優(yōu)勢與神經(jīng)局限
脂肪來源基質細胞/干細胞(ADSC)作為易獲取、增殖快的間充質細胞源,可分化為脂肪、骨、軟骨及肌肉等中胚層組織,且適用于自體移植規(guī)避排斥風險。然而,其跨胚層(尤其神經(jīng)譜系)分化證據(jù)薄弱,在神經(jīng)退行性疾病動物模型中亦未展現(xiàn)明確治療效益,現(xiàn)階段主要應用于中胚層組織修復而非神經(jīng)再生。
結語:從實驗室到臨床——干細胞療法的希望與挑戰(zhàn)
干細胞治療神經(jīng)退行性疾病的探索,標志著再生醫(yī)學向攻克“神經(jīng)修復不可能三角”(替代、再生、功能整合)邁出了關鍵一步。當前的研究已勾勒出四大核心細胞類型的治療版圖:
- 多能干細胞(PSCs):以胚胎干細胞(ESCs)和誘導多能干細胞(iPSCs)為代表,憑借全能分化能力成為細胞替代的主力軍。2025年《自然》期刊發(fā)表的帕金森病臨床試驗證實,iPSC與ESC衍生的多巴胺能神經(jīng)元移植可安全重建運動功能,為臨床轉化掃除了致瘤性疑慮;
- 間充質干細胞(MSCs):依托強免疫調節(jié)與神經(jīng)營養(yǎng)分泌,在阿爾茨海默病、多發(fā)性硬化等疾病中通過改善微環(huán)境延緩神經(jīng)退變,臍帶來源MSCs更成為標準化治療的優(yōu)選;
- 神經(jīng)干細胞(NSCs):兼具原位整合與多向分化潛能,在脊髓損傷和腦卒中模型中通過替代神經(jīng)元與促進髓鞘再生實現(xiàn)功能重建;
- 創(chuàng)新細胞資源:如子宮內膜再生細胞(ERCs)的無創(chuàng)獲取、臍血干細胞的低免疫原性,為個體化治療提供了更多選擇。
然而,臨床落地仍面臨三重挑戰(zhàn):
- 安全性瓶頸:iPSC的致瘤風險、ESC的倫理爭議,以及移植后細胞在衰老微環(huán)境中的低存活率;
- 技術標準化困境:干細胞分化的批次差異、給藥途徑(如腦內注射vs無創(chuàng)鼻黏膜遞送)的優(yōu)化亟待突破;
機制認知鴻溝:移植細胞與宿主神經(jīng)環(huán)路的電生理整合效率、免疫排斥的長期調控仍不明確。
未來方向已現(xiàn)端倪:
- 技術融合:干細胞搭載納米載體(如工程化外泌體)可穿透血腦屏障,提升藥物腦內濃度3-5倍;
- 策略升級:“R3范式”(Rejuvenation/Regeneration/Replacement)通過部分重編程逆轉細胞衰老,聯(lián)合基因編輯修正致病突變;
- 個體化醫(yī)療:自體iPSC庫構建結合AI分型技術,將實現(xiàn)“量體裁衣”式的神經(jīng)修復方案。
正如2025年清華大學國際會議所展望:當干細胞治療與基因編輯、微環(huán)境重塑技術深度協(xié)同,人類終將跨越神經(jīng)再生的最后屏障,讓退行的大腦重獲新生。這條路雖遠,但每一步都在靠近光明。
免責說明:本文僅用于傳播科普知識,分享行業(yè)觀點,不構成任何臨床診斷建議!杭吉干細胞所發(fā)布的信息不能替代醫(yī)生或藥劑師的專業(yè)建議。如有版權等疑問,請隨時聯(lián)系我。



 掃碼添加官方微信
掃碼添加官方微信