急性缺血性卒中是動脈內干細胞輸注的主要應用領域之一,也突顯了干細胞治療神經系統疾病面臨的獨特挑戰。有效的動脈干細胞輸注是一個復雜過程,需要合理選擇并制備具有免疫相容性的干細胞、在最佳時機注射最佳劑量以確保細胞最大存活率、并采用方法追蹤細胞的輸送與沉積。
深入理解這些挑戰的基礎,在于對干細胞本身的認知。該療法面臨的挑戰重大,涉及患者篩選、干細胞類型與來源、針對特定應用的制備與優化、安全劑量確定、注射過程中對細胞輸送與攝取的監測,以及治療后反應評估。

動脈輸注干細胞治療缺血性中風的技術挑戰、優化策略與臨床轉化前景
鑒于動脈輸注在神經系統疾病治療,尤其是中風治療中的潛力日益受到關注,近期,國際權威期刊雜志《Arterial Treatment of Neurological Diseases》發表了一篇“動脈內輸送干細胞:干細胞在中風治療中的作用”的研究綜述[1]。

作為該領域的系統梳理,本章將綜述動脈干細胞輸注的來源、處理流程、應用范圍、現存局限及其潛在前景。
在具體探討動脈輸注的應用之前,有必要先明確相關干細胞的核心概念。
干細胞核心特性與基礎術語
在深入討論干細胞之前,需明確其核心概念。
干細胞的核心特性包括:自我更新能力(產生與自身完全相同的子細胞)、分化能力(進入特定細胞譜系并轉變為具有特定形態和功能的終末細胞),以及相對較少被強調的功能性重建(發揮與原組織相同的功能)。
另一個關鍵術語是多能性(Potency),它描述干細胞向不同細胞類型分化的潛能。
可塑性(Plasticity)則特指成體細胞分化并獲得新表型身份的能力。
基于上述多能性差異,干細胞可進一步分類:干細胞類型與分化潛能(基于多能性)
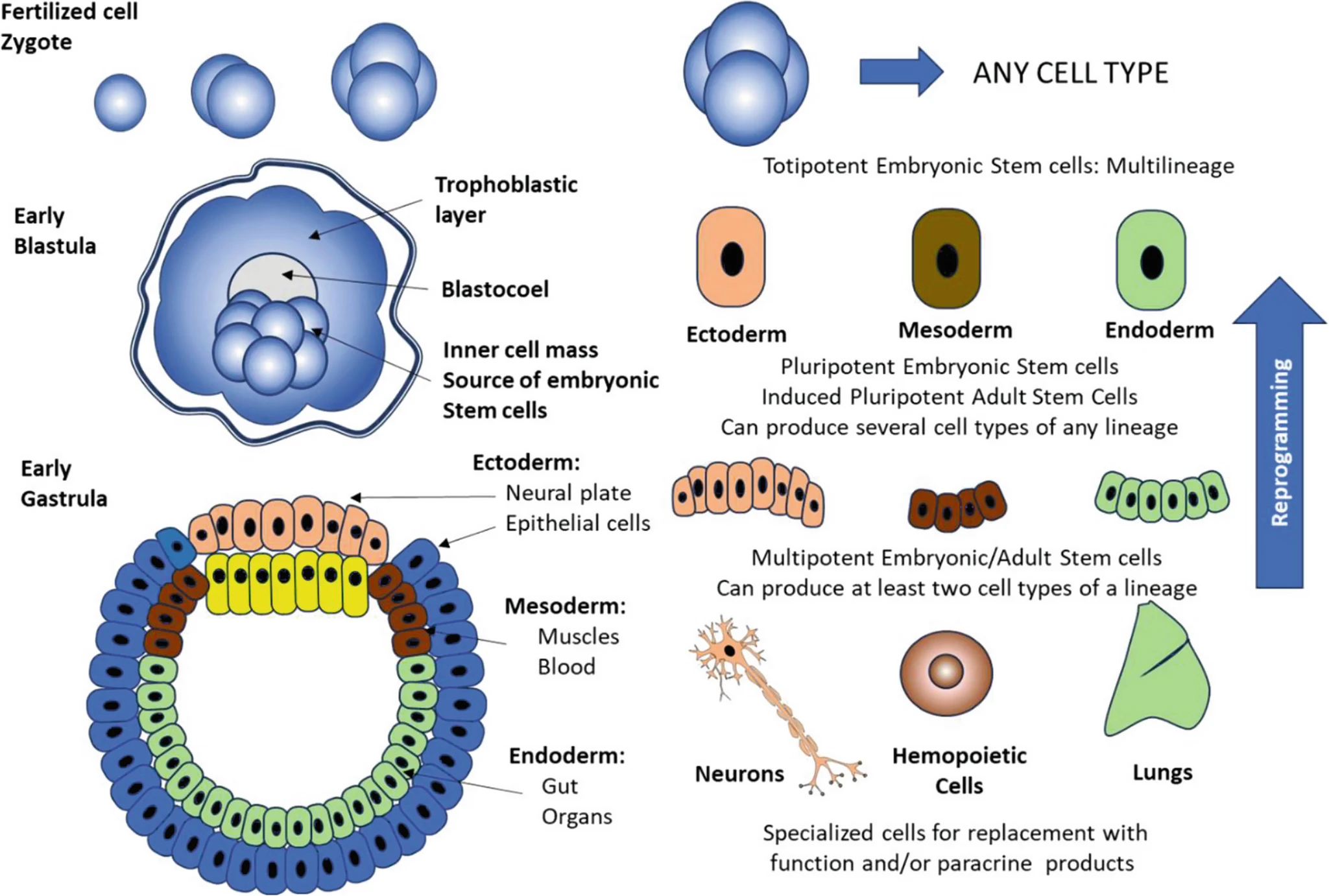
干細胞根據分化潛能分類:全能性(Totipotent)干細胞(如受精卵早期分裂球)能分化為包括胚外組織(如胎盤)在內的所有細胞類型。胚胎干細胞(ESCs)來源于囊胚內細胞團,屬于多能性(Pluripotent)干細胞,能分化為所有成體細胞類型(來自內胚層、中胚層、外胚層這三大胚層)。
多潛能性(Multipotent)干細胞(如成體干細胞)則局限于特定譜系內分化(如造血干細胞分化為多種血細胞)。
胚胎發育中的原腸胚形成(Gastrulation)過程形成了三大胚層:內胚層(發育為內臟器官)、中胚層(發育為肌肉、血細胞等)和外胚層(發育為皮膚、神經元等)。
與多能干細胞密切相關但特性不同的細胞類型還包括:前體細胞、干性、微環境與成體干細胞分布
前體細胞(Progenitor cells)雖具有自我更新和分化能力,但其譜系限制更嚴格、增殖能力較弱(如神經前體細胞僅分化為神經細胞)。
干性(Stemness)指細胞自我更新并分化替代健康細胞的能力,但異常時可能導致惡性轉化。
干細胞存在于特定的微環境(Niche)中,這為其提供功能性支持。成體干細胞廣泛分布于組織中,例如骨髓(含間充質干細胞MSC和造血干細胞HSC)、牙髓、心臟、肝臟、皮膚,以及大腦的室下區和海馬齒狀回下區。
明確了干細胞的基礎特性與分類后, 動脈內輸送干細胞治療腦中風的干細胞來源
胚胎干細胞(Embryonic stem cells):?可在胚胎發育的囊胚階段,從內細胞團中的全能細胞獲得(見圖1)。
人多能干細胞(hPSC):可來源于骨髓、臍帶基質、臍帶血、脂肪組織以及其他多個器官。
神經前體干細胞(Progenitor neural stem cells):存在于大腦、脊髓和下丘腦中。
誘導多能干細胞(Induced pluripotent stem cells, iPSC):通過對成體細胞進行重編程和轉化而獲得。
根據供體來源不同,干細胞可分為:
- 自體移植(Autografts): 來源于患者自身;
- 同種異體移植(Allografts):來源于同一物種的供體;
- 異種移植(Xenografts):來源于不同物種。
目前在臨床上易于獲取的干細胞來源主要包括:骨髓、臍帶血、脂肪組織以及牙髓。
為了更系統地比較這些潛在用于治療的干細胞類型。
干細胞的特征
表1總結并擴展了主要干細胞類型及其來源、表面標志以及優缺點。
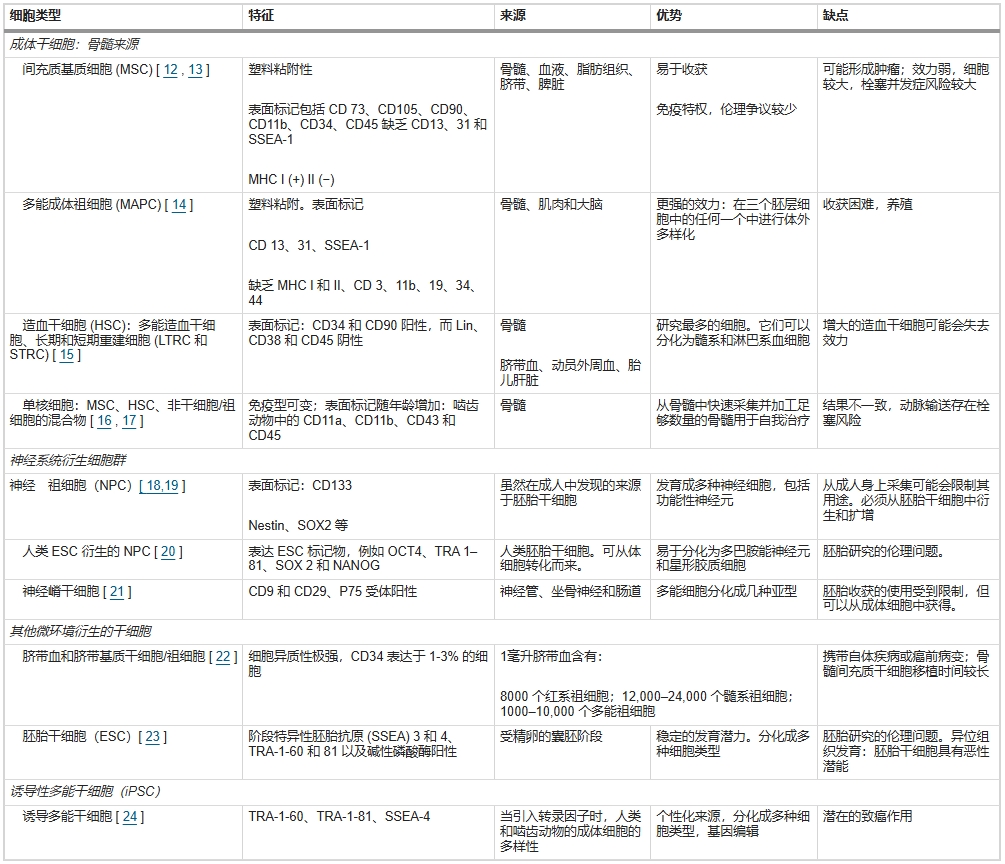
在神經系統疾病治療中,以下幾種干細胞類型尤為關鍵:與神經系統應用相關的干細胞
胚胎干細胞 (ESC):胚胎干細胞 (ESC) 源自早期哺乳動物胚胎的內細胞團,具有無限增殖能力并保持多能性(可分化為三個胚層的所有細胞類型)。然而,這種強大的增殖潛力也帶來了致瘤風險。其來源于胚胎的特性引發了重要的倫理問題,限制了其直接臨床應用(通常需先轉化為特定前體細胞)。
盡管如此,ESC在動物模型(包括靈長類)中已顯示出對帕金森病、肌萎縮側索硬化癥 (ALS) 和多發性硬化癥的治療潛力。由于倫理考量,ESC在研究和潛在治療中的應用已很大程度上被誘導性多能干細胞 (iPSC) 所取代。
誘導性多能干細胞 (iPSC):誘導性多能干細胞 (iPSC) 通過重編程成體細胞(如皮膚或血細胞)獲得,其功能類似ESC,但規避了胚胎來源的倫理爭議。重編程通過引入關鍵轉錄因子(如OCT4, SOX2, KLF4, MYC)實現。
iPSC的核心應用在于構建神經系統疾病模型(涵蓋脆性X綜合征、唐氏綜合征、帕金森病、阿爾茨海默病等),包括創建含人神經元/膠質細胞的人鼠嵌合腦以及用于藥物研究的2D/3D類腦器官。
雖然iPSC在理解神經疾病(如帕金森病、亨廷頓病、ALS、脊髓性肌萎縮癥)和推動臨床應用方面潛力巨大,但仍面臨重編程一致性、規模化生產、質量控制以及潛在的致瘤性等挑戰。探索利用其分泌組(而非完整細胞)可能是克服部分挑戰的途徑。
間充質干細胞(MSCs):MSCs存在于許多成人組織、臍帶血和基質(沃頓氏膠狀物)中。這些細胞的特點是粘附在塑料表面。它們很大,大小為5到50微米。
MSC易于分離和處理。這些細胞存在于骨髓、臍帶/臍帶血、胎盤、羊水、脂肪組織、牙齒組織、唾液腺、滑液和經血中。MSCs可以替代細胞、抑制炎癥反應、具有神經保護和抗凋亡作用,并促進血管生成。它們還可以作為藥物微膠囊和溶瘤病毒的治療載體。
MSCs外泌體可能能夠穿透血腦屏障 (BBB)。干細胞用于治療缺血性中風的原理是,與缺血、炎癥、細胞凋亡、血管生成、免疫反應和神經可塑性相關的多種損傷途徑決定了中風的預后,而所有這些因素都可以通過干細胞改變。
神經干細胞(NSC)和神經祖細胞(NPC):神經干細胞 (NSC) 具有分化為大腦內所有神經細胞類型(神經元、星形膠質細胞、少突膠質細胞)的潛能,而神經祖細胞 (NPC) 則分化能力更為受限,通常來源于胚胎干細胞 (ESC) 或誘導多能干細胞 (iPSC),并已定向發育為神經組織。
這些細胞在胎兒和出生后哺乳動物大腦特定區域(如海馬齒狀回下區、側腦室腦室下區、小腦、視網膜、脊髓)存在,但成年人體內這些細胞群的存在及其功能意義仍有待明確。
將NPC直接注射到目標區域(例如在中風模型中)可改善功能,其機制在于它們在宿主組織中的整合以及釋放的旁分泌信號分子。此外,人類ESC衍生的NPC可被轉化為特定的功能細胞類型,如多巴胺能神經元和星形膠質細胞。
骨髓單核細胞(BM-MNC):BM-MNC是骨髓中的細胞,其細胞核呈圓形或非分葉狀,缺乏細胞質顆粒,具有特征性的干細胞特性。這些細胞包括原始多能干細胞、MSC、小胚胎樣干細胞、多能成體祖細胞、內皮祖細胞、組織定向干細胞和成血管細胞。這些細胞在應激過程中從骨髓釋放,可植入多種受損組織。它們可以與受損組織整合,觸發血管生成,并釋放旁分泌因子。
這些因子具有細胞保護、抗凋亡、抗炎和抗纖維化作用,并有助于募集其他干細胞。BM-MNC是相對較小的干細胞(5-12μm),因此發生栓塞性血管閉塞的風險較低。細胞大小是冠狀動脈注射后植入的重要決定因素。
干細胞輸送方法
干細胞的遞送與藥物的遞送截然不同。干細胞是具有代謝活性的實體。確保從采集到遞送的整個過程中的活力對于細胞替換至關重要,盡管無細胞分泌體注射可以帶來一些益處。與藥物不同,干細胞具有組織向性,并主動遷移至受損或發炎的細胞。
它們的旁分泌因子復雜,在注射部位以外的擴散有限。雖然干細胞的一些免疫調節作用可以遠程實現,但局部遞送可以顯著提高干細胞治療的益處。快速、有效、安全、便捷地將干細胞遞送至目標部位一直是轉化研究的一大難題。
表2列出的干細胞輸送途徑取決于具體應用。對于全身性疾病,靜脈注射是輸送細胞的最佳方式。然而,對于局部病變的治療,局部區域輸送優于靜脈輸送,部分原因是它避免了細胞被肺、肝和脾臟滯留。
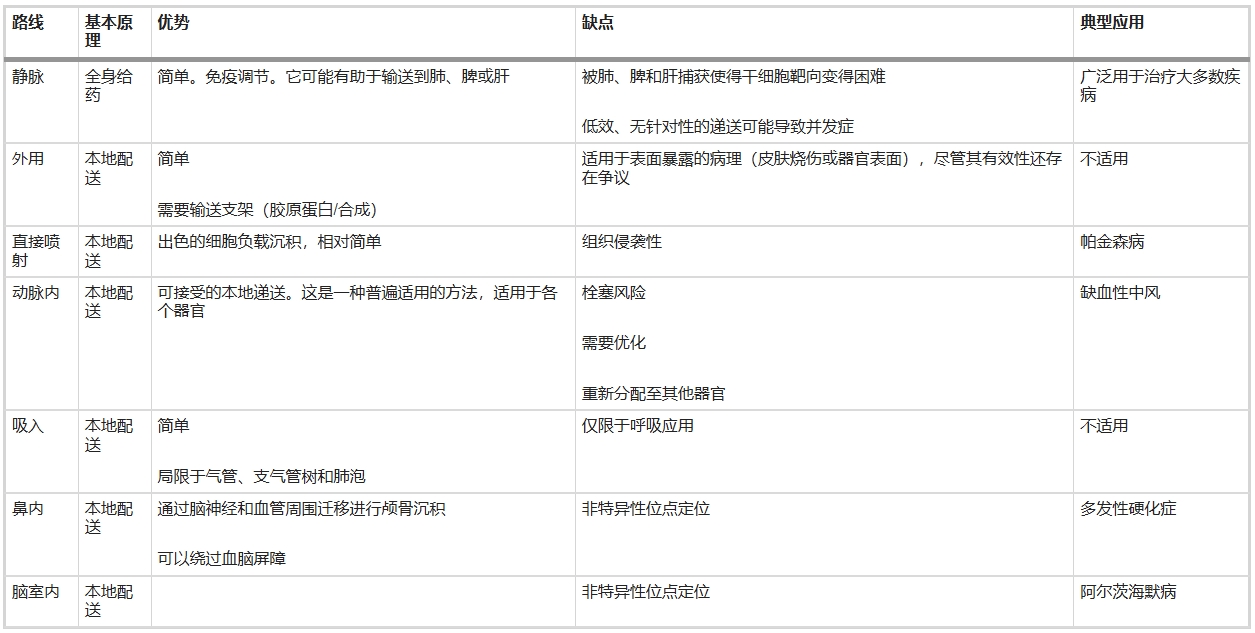
在明確了細胞來源和特性及細胞輸注方法后,其臨床轉化現狀如何?
動脈內輸送干細胞治療中風的臨床試驗
表3列出了國家臨床試驗注冊中心網站上報告的正在進行的急性缺血性中風干細胞試驗。

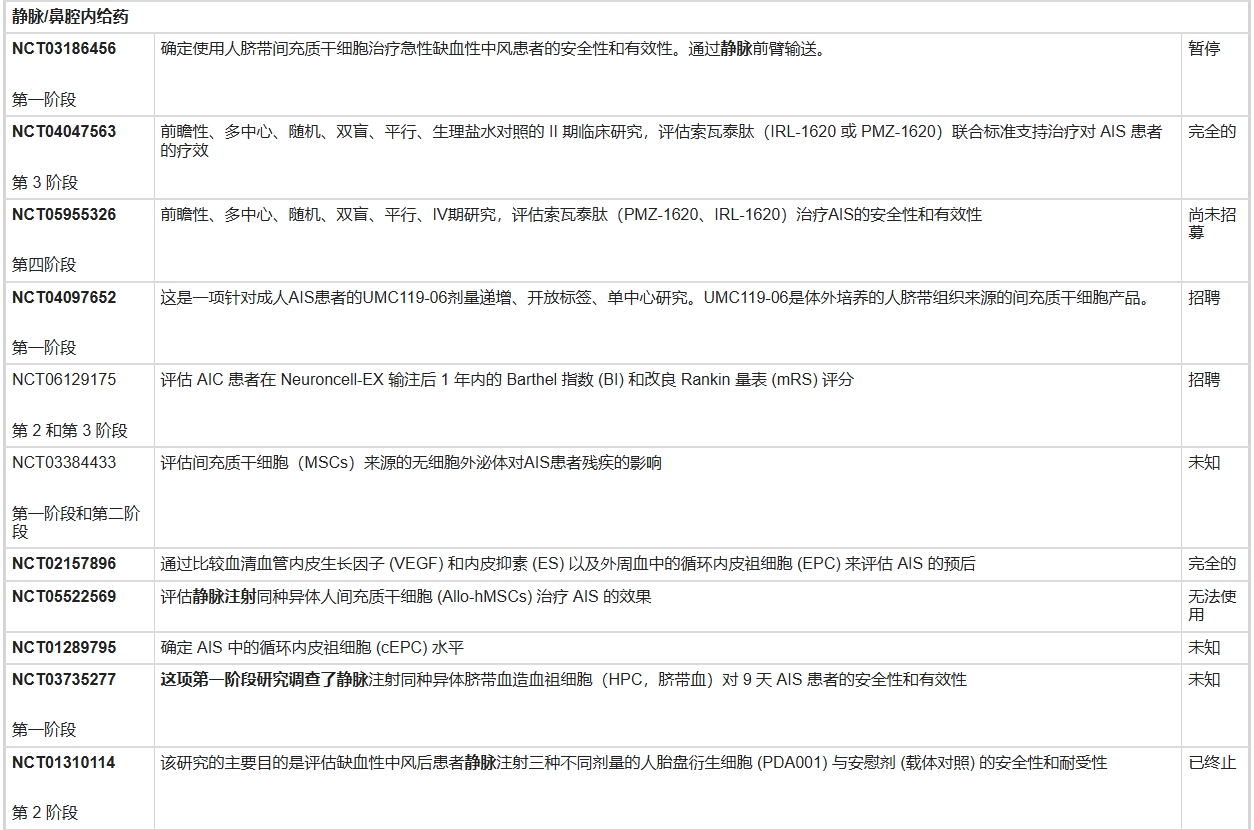
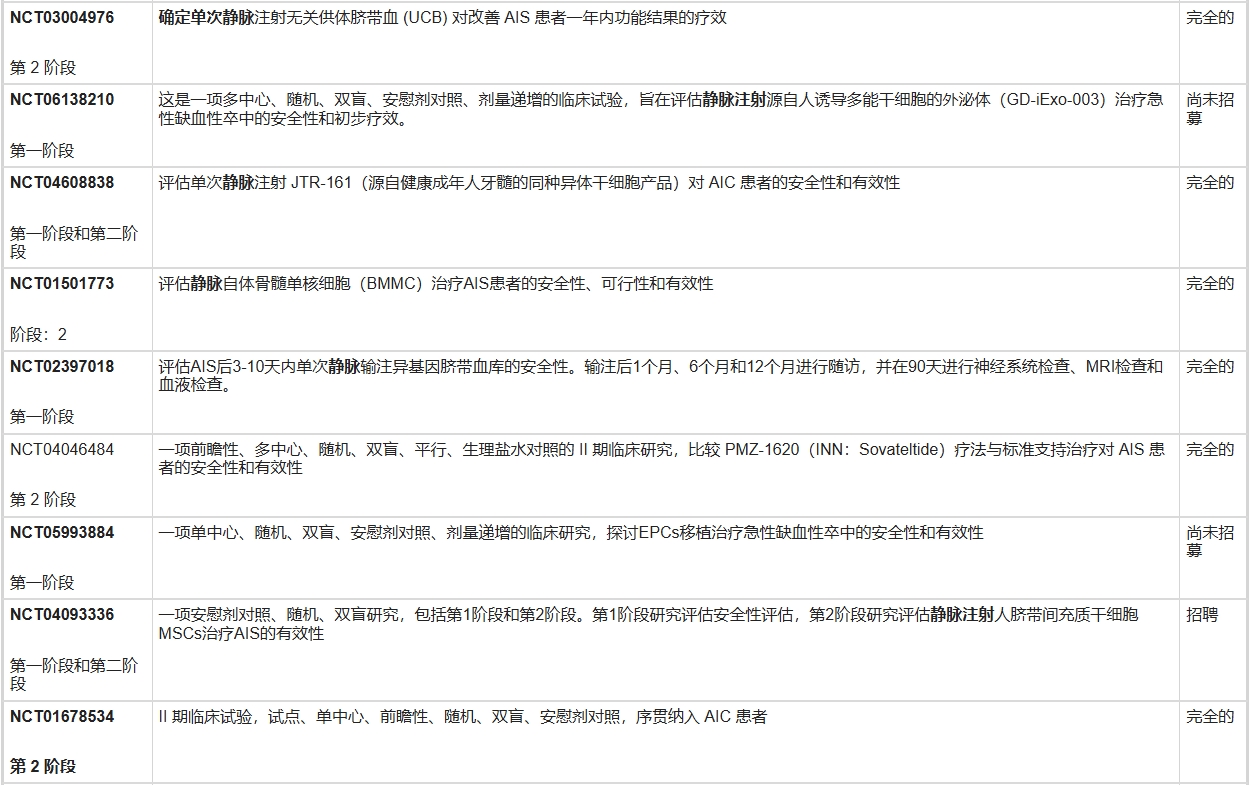
一項包含16項臨床研究的薈萃分析顯示,局部區域性給藥(如立體定向移植或頸動脈內注射)的干細胞輸注顯著優于靜脈輸注。
另一項納入26項研究(其中9項在2010年之前)的薈萃分析表明,不同輸注方式下的干細胞治療均具有良好的耐受性,并呈現出改善神經功能結局的趨勢。
近期一項關于臨床試驗的綜述則探討了動脈內注射干細胞的應用,建議其用于急性卒中治療,但同時提出了關于動脈內注射后細胞再分布的擔憂。
盡管在設計嚴謹、樣本量充分的臨床試驗中,目前尚無確鑿證據證明動脈內干細胞治療可帶來長期獲益,但現有證據已表明干細胞療法具有前景,其輸注方式也不同于傳統藥物。
在過去40年中,藥物性神經保護策略的失敗迫使我們尋求新的治療手段。隨著血管內取栓術(thrombectomy)經驗的積累,干預時間窗正逐步基于灌注參數而延長。干細胞療法有望為超出取栓時間窗或不適合該治療的患者帶來新的希望。
接下來,我們系統分析動脈輸注干細胞治療中風的應用價值及其優缺點
動脈輸注干細胞治療中風的應用與優缺點
廣泛應用與組織適應性:通過動脈注射輸送干細胞在多個器官中均具有應用潛力。雖然這些技術在某些方面相似,但必須根據不同組織的需求進行調整。例如,向肝臟進行動脈干細胞輸注在細胞類型選擇及注射方式上,都與腦部存在顯著差異。
在肝臟中,血管栓塞可能有助于干細胞遞送,而在大腦中,任何栓塞事件都可能加重組織損傷。正如前文所述,不同器官疾病中的動脈給藥存在某些共性,包括:相較于靜脈輸注,動脈輸注具有更強的靶向性,但低于直接注射;細胞大小是決定沉積程度的重要因素;注射細胞數量影響療效;過量細胞可能導致不良結局;干細胞可能從注射部位再分布至肺、肝和脾;使用適當的示蹤標記可追蹤干細胞在局部的動力學;干細胞的療效部分來源于旁分泌效應。
動脈干細胞輸注的優缺點
優點:高濃度輸送至靶部位;避免血容量稀釋;減少被肺、脾和肝清除;療效優于靜脈輸注;與直接注射相比微創;動脈或血管造影操作相對常規且安全;可與其他動脈介入同時實施;跨器官應用潛力大。
缺點:需要動脈穿刺和導管置入;大體積MSC或較高細胞負荷存在栓塞風險;注射壓力或噴射可能導致組織損傷;細胞滯留率可能極低,僅1–5%的注射細胞能沉積;小體積干細胞可能迅速再分布。
鑒于上述優缺點,如何優化動脈干細胞輸注?
動脈干細胞輸注的優化
與藥物輸注的比較:計算機模型表明,動脈藥物輸注在區域血流低、區域提取率高及全身清除率高時效果最佳。然而,這些規律并不能完全應用于活體干細胞。與藥物分子不同,干細胞體積大,存在與其大小直接相關的栓塞風險。因此,過量沉積或過多注射大體積細胞可能有害。
此外,非靶部位清除可能導致干細胞在非靶部位的意外發育甚至惡性轉化。盡管如此,兩者仍有相似之處:動脈輸注可在靶部位遞送大量干細胞,適度降低血流有助于細胞滯留。通過表面標記可改進干細胞追蹤,從而提高局部提取率。與藥物類似,血腦屏障(BBB)阻礙干細胞輸送,因此可通過超聲破壞來增強局部沉積。
具體而言,影響腦內動脈干細胞輸注成功的關鍵因素包括:
細胞大小是首要限制因素:腦毛細血管直徑僅5-10μm,與干細胞尺寸(MNSC:6-12μm, NSC:10-20μm, BMSC:5-50μm)高度重疊。其中MNSC因尺寸最小栓塞風險最低,NSC次之,而體積差異大的BMSC風險最高。研究證實栓塞并發癥發生率與細胞大小呈正相關,白細胞(10-25μm)在毛細血管中的受限運動即是警示。
細胞劑量需精準物種適配:確定安全有效劑量極具挑戰。Guzman團隊提出”細胞數/克腦重”的標準化方法:小鼠耐受極限為7.5×10?細胞/g(超量致血流障礙),而犬類僅0.4×10?細胞/g即出現微栓塞。值得注意的是,大鼠可耐受150×10?細胞/g的MNSC,但NSC在10×10?細胞/g時已引發栓塞。輸注時必須實時監測區域血流,并依據頸動脈灌注范圍進行權重校正。
灌注速度須嚴格生理適配:血管造影中對比劑推注速率(頸總動脈7-10mL/s)遠超實際血流量,操作中依賴人工調節壓力。過高壓力可能導致出血(類似動脈化療并發癥)。干細胞輸注需精確控制速率,避免因超生理流速引發血管損傷或細胞栓塞。
注射時機依賴病理時間窗:動物研究表明:干細胞療效具有嚴格時間依賴性。亞急性期(再灌注后48-72小時)為黃金窗口——此時血腦屏障(BBB)破壞利于細胞植入,而過早輸注(<24小時)會因缺血酸中毒降低細胞存活率。多數研究反對在再灌注同時給藥。
干細胞特性決定整合效能:自體骨髓/間充質干細胞(BMSC)免疫原性低,但在神經組織中整合能力有限;神經干細胞(NSC)雖能高效整合,其分化方向卻難精準調控。選擇細胞類型需權衡免疫相容性與靶向分化能力這對矛盾。
為了克服這些影響因素,可采取以下輔助措施:輔助措施以改善動脈干細胞輸注:
冠狀動脈中使用“血流阻斷”可提高輸注效果,但在卒中中則可能加重缺血損傷;BBB破壞;優化培養條件:在神經生長因子(NGF)及腦源性神經營養因子(BDNF)作用下培養干細胞,可在創傷性腦損傷后24小時將MSC的植入率提高約15–20%;配體修飾:在NSCs表面富集CD49等配體,可增強其與血管內皮的黏附能力;磁性靶向:與腦室內或靜脈輸注類似,磁性靶向可提高動脈輸注效果。
綜合以上討論,動脈輸注干細胞治療中風的未來挑戰與應用
治療價值與臨床現狀:缺血性中風占所有中風的80%,傳統神經保護藥物研發因數百項臨床試驗失敗而陷入困境。干細胞的再生能力、抗凋亡及細胞保護作用為其提供了突破性治療潛力。
動脈輸注被視為急性缺血性中風的首選途徑,因其可借助現有動脈介入技術(如血栓切除術)直接靶向病灶,且臨床前研究顯示其效果優于靜脈輸注。然而,目前針對神經系統疾病的動脈干細胞治療臨床研究遠少于心臟疾病(表3),凸顯該領域的探索不足。
動脈輸注面臨多重挑戰:
細胞選擇與制備:需嚴格篩選免疫相容干細胞(如避免MSC栓塞風險或MNSC效力不足);精準遞送:需在最佳時間窗注入精確劑量,確保細胞有效沉積且不阻塞血流;監測技術:依賴影像實時追蹤細胞輸送(如MRI標記干細胞);設備整合:亟需開發CT-MRI一體機(圖4),解決傳統分設備掃描導致的圖像配準延誤,為干細胞輸注爭取關鍵時間。
創新替代方案——干細胞衍生物
鑒于完整干細胞的應用風險(如栓塞、惡性轉化),未來策略轉向干細胞衍生物:干細胞分泌組:含細胞保護/抗炎因子,無栓塞風險,可立即用于微循環未恢復的急性期;外泌體(40-160nm):遞送治療性物質,兼具組織向性和安全性。兩者可儲存備用,免疫風險極低,并為后續完整干細胞治療創造有利條件。
未來治療范式
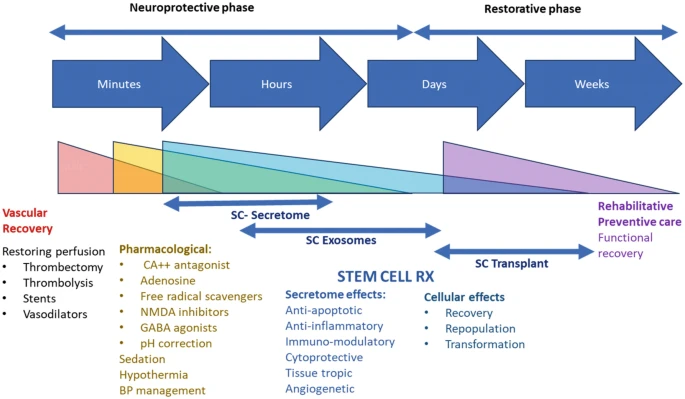
動脈干細胞治療需從”單次輸注”轉向多階段序貫治療(圖5):急性期:用分泌組/外泌體保護組織;恢復期:待灌注改善后輸注完整干細胞促進再生;影像指導:通過一體化CT-MRI動態優化策略。這種”產品組合+精準時序”的模式,有望為缺血性中風提供全新解決方案。
綜上所述,得出以下結論:
現狀與核心挑戰:當前干細胞療法的臨床應用僅獲批用于血液疾病,FDA尚未批準任何外泌體產品。盡管再生醫學領域已投入大量資源開發干細胞及其衍生物(外泌體、分泌組),并在多學科積極驗證其潛力,有效遞送仍是最大技術瓶頸。
相較于易于靶向操作的眼科、牙科領域(可能率先獲批),神經系統因遞送障礙尤為突出,而動脈輸注憑借其與腦組織的直接通路成為有吸引力的解決方案——尤其在血管內技術成熟的中風治療中。
前景與方向
動脈輸注干細胞治療中風的核心在于精準策略:需結合血流動力學選擇適宜細胞類型、優化給藥時機與劑量。未來突破點可能優先來自干細胞分泌組(而非完整細胞移植),因其能規避栓塞風險并發揮旁分泌保護效應。盡管動脈輸注在其他神經系統疾病的應用尚處早期,但其有望成為中風治療的核心突破口,為再生醫學提供新范式。
參考資料:
[1]:Ramos, A., Joshi, S. (2025). Intra-arterial Delivery of Stem Cells: Their Role in Stroke Treatment. In: Joshi, S. (eds) Arterial Treatment of Neurological Diseases. Springer, Cham. https://doi.org/10.1007/978-3-031-80173-0_15
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加官方微信
掃碼添加官方微信