缺血性中風(fēng)的臨床治療方法有限。神經(jīng)干細(xì)胞 (NSC) 移植可能是一種有前途的治療方法。臨床上,缺血和隨后的再灌注會(huì)導(dǎo)致廣泛的神經(jīng)血管損傷,包括炎癥、血腦屏障破壞和腦細(xì)胞死亡。NSC表現(xiàn)出多種潛在的治療神經(jīng)血管損傷的作用。目前,組織纖溶酶原激活劑 (tPA) 是唯一獲得FDA批準(zhǔn)的溶栓劑。雖然tPA在血管內(nèi)的溶栓作用是有益的,但tPA的非溶栓有害作用會(huì)加重神經(jīng)血管損傷,限制治療時(shí)間窗口(時(shí)間敏感)和tPA資格。
因此,需要新的策略來減輕tPA的有害影響并快速介導(dǎo)中風(fēng)后的血管修復(fù)。到目前為止,臨床試驗(yàn)主要關(guān)注干細(xì)胞療法通過在慢性中風(fēng)階段輸送細(xì)胞對(duì)神經(jīng)修復(fù)的影響。此外,NSC還會(huì)分泌刺激早期缺血性中風(fēng)內(nèi)源性修復(fù)機(jī)制的因子。
神經(jīng)干細(xì)胞移植:成為治療早期缺血性中風(fēng)時(shí)間窗困境的關(guān)鍵策略
本綜述將綜合介紹神經(jīng)干細(xì)胞移植作為神經(jīng)血管損傷有希望的治療方法的臨床前觀點(diǎn),重點(diǎn)是早期缺血性中風(fēng)。此外,這將突出早期亞急性神經(jīng)干細(xì)胞輸送對(duì)改善短期和長(zhǎng)期中風(fēng)結(jié)果的影響[1]。

神經(jīng)干細(xì)胞移植:突破缺血性腦卒中早期治療的時(shí)間窗困境
腦卒中仍是美國(guó)致死和致殘的首要原因,其中缺血性腦卒中占所有腦卒中病例的87%。衰老是神經(jīng)血管疾病的主要風(fēng)險(xiǎn)因素之一,約三分之二的腦卒中患者年齡超過65歲。
臨床上,缺血-再灌注(IR)導(dǎo)致廣泛的神經(jīng)血管損傷和神經(jīng)功能障礙。雖然缺血性卒中的發(fā)病率很高,但治療手段僅限于機(jī)械性血管內(nèi)治療(血栓切除術(shù))和組織型纖溶酶原激活劑(tPA)靜脈溶栓。
一、缺血性腦卒中現(xiàn)有治療手段的瓶頸?
(一)tPA溶栓治療的臨床局限?
組織纖溶酶原激活劑(tPA)作為唯一獲 FDA 批準(zhǔn)的靜脈溶栓藥物,其臨床應(yīng)用受限于兩大核心問題:?
- 時(shí)間窗極度狹窄:僅發(fā)病后4.5小時(shí)內(nèi)適用(占所有患者不足10%),超過此時(shí)間窗則出血轉(zhuǎn)化風(fēng)險(xiǎn)顯著升高(癥狀性顱內(nèi)出血率達(dá)6.4%)
- 非溶栓毒性作用:tPA通過激活纖溶系統(tǒng)以外的途徑(如誘導(dǎo)基質(zhì)金屬蛋白酶 – 9表達(dá))加劇血腦屏障(BBB)破壞,形成 “再灌注損傷” 級(jí)聯(lián)反應(yīng)。
(二)機(jī)械取栓的適用邊界擴(kuò)展困境?
盡管灌注成像指導(dǎo)下的機(jī)械取栓可將時(shí)間窗延長(zhǎng)至24小時(shí),但:?僅約15% 患者符合篩選標(biāo)準(zhǔn)(需存在可挽救的缺血半暗帶),延遲再灌注(>6 小時(shí))仍伴隨不可逆 BBB 損傷:第二次 BBB 破壞高峰(發(fā)病后 24-72 小時(shí))導(dǎo)致神經(jīng)血管單元崩潰。
因此,需要新的策略來延長(zhǎng) tPA 的治療窗口,最大限度地減少有害影響,并改善中風(fēng)的結(jié)果。
神經(jīng)干細(xì)胞 (NSC) 具有多效性,對(duì)非常復(fù)雜的早期卒中病理生理學(xué)有益。植入的 NSC 可分化為腦內(nèi)功能性神經(jīng)元,同時(shí)還具有旁觀者(分子伴侶)效應(yīng),包括傳遞神經(jīng)營(yíng)養(yǎng)因子,從而緩解有毒微環(huán)境并保護(hù)瀕危宿主細(xì)胞。
二、神經(jīng)干細(xì)胞治療缺血性中風(fēng)的早期干預(yù)優(yōu)勢(shì)?
(一)多模態(tài)靶向早期病理機(jī)制?
| 作用機(jī)制? | 具體效應(yīng)? | 臨床前證據(jù)來源? |
| BBB保護(hù)? | 分泌血管內(nèi)皮生長(zhǎng)因子(VEGF)、緊密連接蛋白(ZO-1),減少TJ蛋白降解 | 大鼠MCAO模型 |
| 神經(jīng)炎癥調(diào)控? | 抑制小膠質(zhì)細(xì)胞過度活化(降低 IL-6、TNF-α水平),促進(jìn)M2型極化 | 小鼠缺血再灌注模型 |
| 內(nèi)源性修復(fù)激活? | 釋放腦源性神經(jīng)營(yíng)養(yǎng)因子(BDNF)、膠質(zhì)細(xì)胞源性神經(jīng)營(yíng)養(yǎng)因子(GDNF) | 非人靈長(zhǎng)類動(dòng)物研究 |
(二)時(shí)間窗突破的關(guān)鍵節(jié)點(diǎn)?
- 亞急性期干預(yù)窗口:發(fā)病后24小時(shí)-7天(對(duì)應(yīng)第二次BBB破壞前的可逆階段)?
- 早期移植(<72小時(shí))可顯著抑制神經(jīng)細(xì)胞凋亡(TUNEL陽性細(xì)胞減少40%)
- 延遲至慢性期(>1個(gè)月)則主要發(fā)揮神經(jīng)重塑作用,對(duì)BBB保護(hù)效果減弱
此外,NSC 的治療結(jié)果可能因 NSC 給藥時(shí)間和途徑而異。雖然目前的臨床試驗(yàn)主要集中于慢性中風(fēng)階段注射細(xì)胞對(duì)神經(jīng)修復(fù)的影響,但本綜述將重點(diǎn)關(guān)注缺血性中風(fēng)早期(亞急性)階段NSC移植的治療機(jī)制和潛力,從而改善長(zhǎng)期結(jié)果。
神經(jīng)干細(xì)胞生物學(xué)
內(nèi)源性神經(jīng)干細(xì)胞的特性與局限性
一、特性
存在部位特定性
內(nèi)源性神經(jīng)干細(xì)胞(NSC)主要分布于成年哺乳動(dòng)物中樞神經(jīng)系統(tǒng)的特定區(qū)域,如海馬齒狀回的顆粒下層(SGZ)和側(cè)腦室的室下區(qū)(SVZ)。這些區(qū)域的微環(huán)境(niche)通過分泌神經(jīng)營(yíng)養(yǎng)因子和細(xì)胞因子,維持干細(xì)胞的靜息狀態(tài)或激活其增殖分化。
自我更新與多向分化潛能:內(nèi)源性NSC具有對(duì)稱分裂(產(chǎn)生兩個(gè)干細(xì)胞)和不對(duì)稱分裂(產(chǎn)生一個(gè)干細(xì)胞和一個(gè)祖細(xì)胞)的能力,可分化成神經(jīng)元、星形膠質(zhì)細(xì)胞及少突膠質(zhì)細(xì)胞,參與神經(jīng)修復(fù)和功能重建。
微環(huán)境依賴性激活:其增殖和分化受微環(huán)境中的信號(hào)分子調(diào)控,如Wnt、Notch、bHLH等信號(hào)通路。例如,促有絲分裂因子(如EGF、bFGF)可激活NSC增殖,而神經(jīng)營(yíng)養(yǎng)素(如BDNF)則促進(jìn)其分化。
標(biāo)記蛋白特征:在增殖階段表達(dá)早期標(biāo)志物(如Nestin、BrdU),遷移階段表達(dá)PSA-NCAM、Doublecortin(DCX),成熟后表達(dá)NeuN(神經(jīng)元)或GFAP(膠質(zhì)細(xì)胞)等特異性標(biāo)記蛋白。
原位修復(fù)潛力:通過激活內(nèi)源性NSC,可避免外源性干細(xì)胞移植的免疫排斥風(fēng)險(xiǎn),并直接參與局部神經(jīng)網(wǎng)絡(luò)的修復(fù)。例如,DLX2轉(zhuǎn)錄因子可誘導(dǎo)星形膠質(zhì)細(xì)胞重編程為神經(jīng)祖細(xì)胞,進(jìn)而生成功能性神經(jīng)元。
二、局限性
數(shù)量與再生能力有限:成年哺乳動(dòng)物內(nèi)源性NSC數(shù)量稀少,且其增殖能力隨年齡增長(zhǎng)顯著下降。在嚴(yán)重神經(jīng)損傷或退行性疾病中,內(nèi)源性NSC的再生能力不足以完全修復(fù)損傷。
微環(huán)境抑制因素:損傷后局部微環(huán)境常被炎癥因子(如TNF-α、IL-1β)或膠質(zhì)瘢痕(星形膠質(zhì)細(xì)胞過度增生)破壞,抑制NSC的激活與分化。例如,膠質(zhì)瘢痕釋放的硫酸軟骨素蛋白多糖會(huì)阻礙神經(jīng)元軸突再生。
分化效率與功能整合不足:即使NSC被激活,其分化為功能性神經(jīng)元的比例較低,更多分化為膠質(zhì)細(xì)胞。此外,新生神經(jīng)元可能無法有效整合到現(xiàn)有神經(jīng)網(wǎng)絡(luò)中,導(dǎo)致功能恢復(fù)受限。
調(diào)控機(jī)制復(fù)雜且易失衡:內(nèi)源性NSC的激活涉及多信號(hào)通路協(xié)同作用,調(diào)控不當(dāng)可能導(dǎo)致異常分化或腫瘤形成。例如,過度激活Notch信號(hào)可能抑制神經(jīng)元分化,促進(jìn)膠質(zhì)細(xì)胞生成。
遷移能力受限:內(nèi)源性NSC的遷移范圍通常局限于特定區(qū)域(如SVZ向嗅球遷移),難以到達(dá)遠(yuǎn)隔損傷部位。即使通過干預(yù)手段促進(jìn)遷移,其效率仍遠(yuǎn)低于外源性干細(xì)胞移植。
神經(jīng)干細(xì)胞的來源及神經(jīng)干細(xì)胞衍生技術(shù)的突破與臨床潛力
神經(jīng)干細(xì)胞可以通過多種方法從各種來源獲得(圖1)。NSC 可直接從胎兒組織的神經(jīng)外胚層或成人的SVZ和SGZ中獲取。這些原代NSC可使用堿性成纖維細(xì)胞生長(zhǎng)因子 (bFGF) 和表皮生長(zhǎng)因子 (EGF) 在培養(yǎng)中擴(kuò)增和維持。
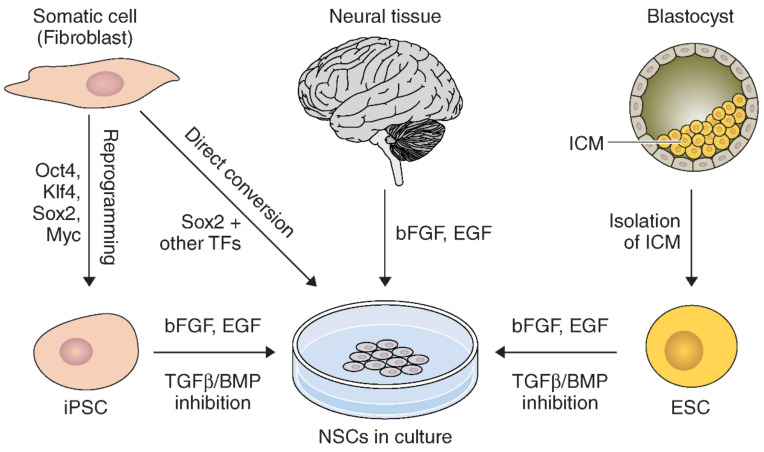
NSC可直接從神經(jīng)組織中提取并在體外擴(kuò)增。此外,NSC 可以通過分化因子的特定組合從 iPSC 或 ESC重新編程。此外,NSC 可以通過直接轉(zhuǎn)化體細(xì)胞生成,而無需 iPSC 衍生步驟。
NSC也可以來自其他來源。例如,NSC可由胚胎干細(xì)胞 (ESC) 生成。然而,ESC需要大量的操作和中間步驟才能完全分化為 NSC。通過在用bFGF和EGF擴(kuò)增期間抑制TGFβ/BMP信號(hào)通路,可實(shí)現(xiàn)培養(yǎng)ESC的神經(jīng)誘導(dǎo)。其中誘導(dǎo)多能干細(xì)胞(iPSCs)技術(shù)因自體來源規(guī)避了倫理與免疫排斥問題。
最新直接重編程技術(shù)(如iNSCs)通過特定轉(zhuǎn)錄因子組合,將體細(xì)胞直接轉(zhuǎn)化為NSCs,大幅提升效率并簡(jiǎn)化流程。這些技術(shù)為個(gè)性化、低風(fēng)險(xiǎn)的腦卒中細(xì)胞治療奠定了堅(jiān)實(shí)基礎(chǔ),尤其是iNSCs的快速制備與高兼容性,為突破傳統(tǒng)療法局限提供了新方向。
外源性神經(jīng)干細(xì)胞的標(biāo)記與追蹤
外源性神經(jīng)干細(xì)胞(NSCs)的標(biāo)記與追蹤方法多樣。直接標(biāo)記法通過移植前在干細(xì)胞內(nèi)或表面引入標(biāo)記物實(shí)現(xiàn),常用策略包括:
- 胸腺嘧啶類似物BrdU標(biāo)記:通過抗體檢測(cè)分裂中的BrdU+細(xì)胞,適用于短期追蹤(因標(biāo)記隨時(shí)間稀釋);
- 超順磁性氧化鐵顆粒(SPIO)標(biāo)記:結(jié)合磁共振成像(MRI)實(shí)現(xiàn)臨床可轉(zhuǎn)化的無創(chuàng)追蹤;
- 熒光探針(如CMTMR、CM-Dil)或放射性示蹤劑標(biāo)記:分別用于光學(xué)成像和核醫(yī)學(xué)成像,但后者可能造成輻射損傷。
此外,病毒轉(zhuǎn)導(dǎo)可令NSCs表達(dá)GFP或lacZ等標(biāo)志物,但存在轉(zhuǎn)基因沉默或細(xì)胞特性改變的風(fēng)險(xiǎn)。對(duì)于跨物種移植(如人源NSCs植入嚙齒類),可通過人特異性抗體或供受體性別差異驗(yàn)證細(xì)胞存活。
神經(jīng)干細(xì)胞遷移機(jī)制
NSCs具有向中樞神經(jīng)系統(tǒng)損傷區(qū)域定向遷移的能力,其趨化性主要依賴病理微環(huán)境釋放的趨化因子(如SDF-1α/CXCL12)與NSCs表面CXCR4受體的相互作用。腦卒中后,梗死周邊可挽救的“半暗帶”因代謝活躍成為NSCs移植的理想靶區(qū)。移植途徑影響遷移效率:
- 顱內(nèi)直接注射:精準(zhǔn)定位半暗帶,但侵入性高;
- 靜脈或動(dòng)脈注射:動(dòng)脈內(nèi)注射可減少肺部截留,提升病灶靶向性;
- 鼻內(nèi)遞送:非侵入性且能廣泛遷移至缺血區(qū)域,但機(jī)制尚未完全明確。
內(nèi)源性神經(jīng)干細(xì)胞修復(fù)早期缺血性腦卒中的機(jī)制
血管生成的雙重作用與年齡相關(guān)挑戰(zhàn)
中風(fēng)后內(nèi)源性血管生成通過修復(fù)缺血半暗帶血供促進(jìn)恢復(fù),但其早期依賴 VEGF 的機(jī)制存在矛盾:VEGF 既能刺激新血管生成,也會(huì)破壞血腦屏障(BBB)加劇水腫。亞急性期局部遞送 VEGF 可平衡修復(fù)與損傷,而全身給藥可能有害。MMPs 參與的 ECM 重塑與 BBB 通透性升高密切相關(guān)。值得注意的是,老年患者的血管生成能力下降,而干細(xì)胞治療可能通過增強(qiáng)血管重塑改善預(yù)后,需進(jìn)一步在老年模型中驗(yàn)證 NSCs 對(duì)血管生成的調(diào)節(jié)作用。
神經(jīng)發(fā)生與血管生成的偶聯(lián)及干預(yù)意義
內(nèi)源性神經(jīng)發(fā)生在中風(fēng)后被激活,NSCs與內(nèi)皮細(xì)胞通過神經(jīng)營(yíng)養(yǎng)因子(如 VEGF)形成功能偶聯(lián),共同促進(jìn)神經(jīng)血管修復(fù)。然而,內(nèi)源性修復(fù)能力有限,需外源性NSCs補(bǔ)充以增強(qiáng)療效。星形膠質(zhì)細(xì)胞在早期具有保護(hù)作用(如清除谷氨酸、促進(jìn)血管生成),但慢性期形成的膠質(zhì)瘢痕會(huì)阻礙恢復(fù)。這為早期干細(xì)胞干預(yù)提供了理論依據(jù)——通過調(diào)節(jié)神經(jīng)血管單元微環(huán)境,抑制過度膠質(zhì)化,從而突破內(nèi)源性。
多效性神經(jīng)干細(xì)胞移植治療缺血性中風(fēng)
大腦在最初的缺血性損傷期間會(huì)發(fā)生顯著變化。NSC 移植的時(shí)機(jī)對(duì)于修復(fù)和再生治療作用至關(guān)重要,可改善缺血性中風(fēng)復(fù)雜、多因素的病理生理學(xué)。移植的 NSC 會(huì)釋放治療性營(yíng)養(yǎng)因子,以重塑腦組織并促進(jìn)神經(jīng)元可塑性。
NSC 分泌的腦源性神經(jīng)營(yíng)養(yǎng)因子 (BDNF) 是一種主要的神經(jīng)營(yíng)養(yǎng)因子,可促進(jìn)神經(jīng)保護(hù)、神經(jīng)發(fā)生并改善中風(fēng)后的神經(jīng)系統(tǒng)結(jié)果。
首先,神經(jīng)營(yíng)養(yǎng)因子 (NTF) 有助于維持神經(jīng)元健康、ECM重塑和細(xì)胞增殖。NTF還能保護(hù)神經(jīng)組織免受廣泛損傷。 VEGF 是一種重要的神經(jīng)營(yíng)養(yǎng)因子,可促進(jìn)血管生成并參與神經(jīng)組織修復(fù)。
其次,VEGF調(diào)節(jié)血管內(nèi)皮細(xì)胞的有絲分裂和存活,并對(duì)缺血性損傷提供神經(jīng)保護(hù)作用。當(dāng)使用 SU1498 和 Flt-1Fc 藥物抑制VEGF時(shí),NSC介導(dǎo)的保護(hù)作用會(huì)顯著受阻。
第三,其他神經(jīng)營(yíng)養(yǎng)因子如睫狀神經(jīng)營(yíng)養(yǎng)因子、神經(jīng)膠質(zhì)細(xì)胞系衍生的神經(jīng)營(yíng)養(yǎng)因子和神經(jīng)生長(zhǎng)因子也有助于神經(jīng)保護(hù)和修復(fù)。
最后,除了分泌神經(jīng)功能因子(NTF)外,植入的神經(jīng)干細(xì)胞還能產(chǎn)生具有電生理活性的功能性神經(jīng)元,這些神經(jīng)元可以與宿主神經(jīng)元建立適當(dāng)?shù)耐挥|連接。
早期干預(yù)的時(shí)間窗與聯(lián)合策略
神經(jīng)干細(xì)胞移植的最佳時(shí)機(jī)為中風(fēng)后亞急性期(24小時(shí)-7天),此時(shí)可與藥物治療(如米諾環(huán)素)協(xié)同作用,通過減輕炎癥和 BBB 損傷保護(hù)神經(jīng)元。臨床前研究證實(shí),中風(fēng)后24小時(shí)移植NSCs能顯著縮小梗死體積,其快速療效與NSCs的抗炎和促修復(fù)因子分泌密切相關(guān)。
血腦屏障(BBB)保護(hù)的核心機(jī)制——MMPs與緊密連接調(diào)控
NSCs 通過抑制 MMP-9 活性保護(hù) BBB:MMP-9 降解 ZO-1 等緊密連接蛋白,導(dǎo)致 BBB 滲漏,而 NSCs 移植可下調(diào) MMP-9 表達(dá),維持 ZO-1完整性。這一作用在老年小鼠和延遲 tPA 治療模型中均被驗(yàn)證,提示 NSCs 可能減輕 tPA 引發(fā)的出血風(fēng)險(xiǎn),擴(kuò)展溶栓治療的安全窗口。
炎癥級(jí)聯(lián)反應(yīng)的負(fù)向調(diào)控
缺血性中風(fēng)激活星形膠質(zhì)細(xì)胞和小膠質(zhì)細(xì)胞,并由于BBB通透性增加導(dǎo)致炎癥細(xì)胞浸潤(rùn)受影響的組織。中風(fēng)早期的 NSC 輸送可減弱這種復(fù)雜的炎癥信號(hào)級(jí)聯(lián)反應(yīng)(圖2: NSC通過降低促炎介質(zhì)(包括TNF-α、IL-1β、IL-6、MCP-1 和 Iba-1)來改善缺血性損傷。
研究表明NSC通過影響細(xì)胞外微環(huán)境和減少神經(jīng)炎癥,在BBB完整性和腦缺血功能恢復(fù)中發(fā)揮重要作用。因此,實(shí)施干細(xì)胞療法進(jìn)行免疫調(diào)節(jié)并針對(duì)大腦中的促炎信號(hào)級(jí)聯(lián)可能是早期缺血性中風(fēng)的有效治療策略。
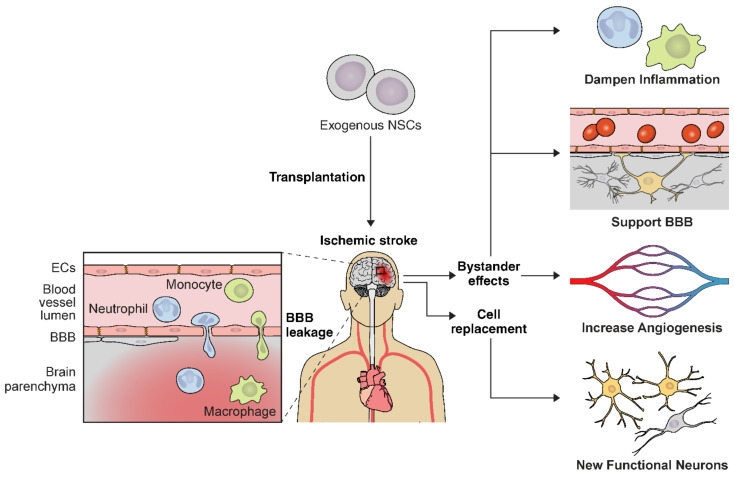
NSC 可在中風(fēng)腦中分化為功能性神經(jīng)元,并具有多效性旁觀者效應(yīng)。這些旁觀者效應(yīng)包括減弱血腦屏障 (BBB) 破壞、增加血管生成和調(diào)節(jié)缺血性中風(fēng)后的免疫反應(yīng)。
長(zhǎng)期修復(fù)的核心機(jī)制 —— 血管生成與神經(jīng)發(fā)生偶聯(lián)
早期 NSCs 移植通過促進(jìn)血管生成改善長(zhǎng)期預(yù)后,其作用與神經(jīng)發(fā)生緊密偶聯(lián)。臨床前研究表明,移植后的 NSCs 可分泌 VEGF 等因子,刺激內(nèi)皮細(xì)胞增殖(如 BrdU+/vWF + 細(xì)胞增加),并在梗死周邊區(qū)形成新生血管網(wǎng)絡(luò)。即使在老年或缺血再灌注模型中,這種血管保護(hù)效應(yīng)仍持續(xù)存在,為神經(jīng)修復(fù)提供必要的營(yíng)養(yǎng)和氧氣支持。
細(xì)胞替代的有限性與旁分泌主導(dǎo)作用
盡管早期移植的NSCs可分化為神經(jīng)元和膠質(zhì)細(xì)胞,但其分化效率較低且多數(shù)細(xì)胞保持未分化狀態(tài)。更關(guān)鍵的是,NSCs 通過旁分泌效應(yīng)(如釋放BDNF、GDNF)激活內(nèi)源性神經(jīng)發(fā)生,而非直接替代受損神經(jīng)元。這一發(fā)現(xiàn)解釋了為何即使細(xì)胞替代比例有限,早期移植仍能顯著改善長(zhǎng)期預(yù)后。
神經(jīng)系統(tǒng)結(jié)果改善的臨床意義與證據(jù)鏈
神經(jīng)行為改善被認(rèn)為是評(píng)估長(zhǎng)期中風(fēng)結(jié)果的黃金標(biāo)準(zhǔn)。改良神經(jīng)系統(tǒng)嚴(yán)重程度評(píng)分 (mNSS) 測(cè)試顯示,當(dāng)在中風(fēng)大鼠腦中 24 小時(shí)時(shí)植入 hNSCs 時(shí),移植兩周后神經(jīng)功能得到改善。
多項(xiàng)動(dòng)物研究一致顯示,早期 NSCs 移植可通過保護(hù) BBB、抑制炎癥和促進(jìn)神經(jīng)血管重塑,實(shí)現(xiàn)長(zhǎng)期神經(jīng)功能的持續(xù)改善。從感覺運(yùn)動(dòng)測(cè)試(前爪黏附物移除)到運(yùn)動(dòng)協(xié)調(diào)性評(píng)估(轉(zhuǎn)棒試驗(yàn)),移植組在數(shù)周至1個(gè)月內(nèi)均表現(xiàn)出優(yōu)于對(duì)照組的行為學(xué)恢復(fù),且這種改善與梗死體積縮小、MMP-9活性抑制及緊密連接蛋白表達(dá)恢復(fù)直接相關(guān)。這些結(jié)果為NSCs 早期干預(yù)進(jìn)入臨床提供了關(guān)鍵的功能學(xué)證據(jù)。
結(jié)論
為了解決神經(jīng)血管疾病復(fù)雜的病理生理學(xué),治療策略包括藥理學(xué)、遺傳學(xué)和基于細(xì)胞的組織工程。NSC 可以單獨(dú)使用,也可以與可以協(xié)同發(fā)揮作用的其他干預(yù)措施結(jié)合使用。具體而言,NSC具有抗炎作用,可以減輕早期卒中延遲的 tPA 相關(guān)不良反應(yīng)。
據(jù)報(bào)道,在慢性卒中期提供人類NSC的1期和 2 期臨床試驗(yàn)沒有顯示出安全問題,并且改善了運(yùn)動(dòng)恢復(fù)。然而,在亞急性卒中期提供干細(xì)胞可能通過改善早期卒中損傷并進(jìn)而改善晚期卒中結(jié)果而使更多患者受益。因此,需要更深入地了解早期卒中損傷并確定最佳的干細(xì)胞策略,才能成功轉(zhuǎn)化。
參考資料:Hamblin MH, Lee JP. Neural Stem Cells for Early Ischemic Stroke. International Journal of Molecular Sciences. 2021 Jul;22(14):7703. DOI: 10.3390/ijms22147703. PMID: 34299322; PMCID: PMC8306669.
免責(zé)說明:本文僅用于傳播科普知識(shí),分享行業(yè)觀點(diǎn),不構(gòu)成任何臨床診斷建議!杭吉干細(xì)胞所發(fā)布的信息不能替代醫(yī)生或藥劑師的專業(yè)建議。如有版權(quán)等疑問,請(qǐng)隨時(shí)聯(lián)系我。



 掃碼添加官方微信
掃碼添加官方微信