阿爾茨海默病(AD)是一種極具破壞性的神經(jīng)認知障礙,是導致癡呆的主要原因。目前,雖然有一些抗淀粉樣蛋白單克隆抗體藥物獲批,但這些藥物存在如淀粉樣相關影像學異常(ARIAs)、輸液相關反應等副作用,因此開發(fā)新的治療策略迫在眉睫。
阿爾茨海默病作為神經(jīng)認知障礙 “頭號殺手”,傳統(tǒng)治療聚焦于淀粉樣蛋白和神經(jīng)原纖維纏結假說,但多款單克隆抗體藥物雖能一定程度改善臨床癥狀,卻伴隨著較高風險的淀粉樣蛋白相關影像學異常(ARIA)及腦萎縮持續(xù)進展等問題,如 lecanemab、aducanumab、donanemab 等藥物,其副作用發(fā)生率不容小覷,迫切需要全新治療策略。
間充質干細胞(MSCs)療法憑借促血管生成、抗炎、免疫調節(jié)及組織修復等多重機制嶄露頭角,laromestrocel 作為一款異體 MSC 療法,在前期 1 期試驗中已展現(xiàn)良好安全性,此次 2a 期試驗進一步間充質干細胞治療阿爾茨海默病中的療效與安全性。
今天要給大家介紹的,就是一種針對輕度阿爾茨海默癥的全新療法 ——laromestrocel 間充質干細胞療法,相關研究成果已發(fā)表于國際期刊《Nature Medicine》。
《nature》最新臨床結果!間充質干細胞治療輕度阿爾茨海默癥緩解腦萎縮
2025年3月10日,美國佛羅里達州邁阿密朗格韋隆研究團隊在國際期刊《Nature Medicine》上發(fā)布了一篇《同種異體間充質干細胞與 laromestrocel 治療輕度阿爾茨海默病:一項隨機對照 2a 期試驗》的研究結果。
研究的主要目的是評估 laromestrocel 治療輕度 AD 的安全性,次要目的是探究其在認知功能、生活質量和腦結構方面的療效。

嚴謹試驗設計:多劑量探索,全面評估
這是一項隨機、雙盲、安慰劑對照的平行組 2a 期臨床試驗,在美國 10 個中心開展。研究團隊將 120 例臨床診斷為輕度 AD 的患者進行篩查,最終 50 例患者入組。患者按 1:1:1:1 隨機分為 4 組,分別接受不同的輸液方案:
- 第 1 組(安慰劑組):每月輸注 1 次安慰劑,共 4 次(n = 12)。
- 第 2 組(2500 萬個細胞單劑量組):第 1 天輸注 2500 萬個 laromestrocel 細胞,隨后 3 個月每月輸注 1 次安慰劑(n = 13)。
- 第 3 組(2500 萬個細胞多劑量組):每月輸注 1 次 2500 萬個 laromestrocel 細胞,共 4 次(n = 13)。
- 第 4 組(1 億個細胞多劑量組):每月輸注 1 次 1 億個 laromestrocel 細胞,共 4 次(n = 11) 。
療效初顯:認知改善,腦萎縮減緩
臨床評估改善:與安慰劑組相比,laromestrocel 治療組在 39 周時多項臨床評估指標表現(xiàn)更優(yōu)。在綜合 AD 評分(CADS)上,第 2 組與安慰劑組的變化差異為 0.38,提示疾病進展有所減緩。蒙特利爾認知評估(MoCA)和日常生活活動能力評估(ADCS-ADL)等方面,laromestrocel 治療組也呈現(xiàn)出改善趨勢,其中 MoCA 評分在第 2 組和聯(lián)合治療組(第 2 – 4 組)與安慰劑組相比,差異具有統(tǒng)計學意義。(圖1)
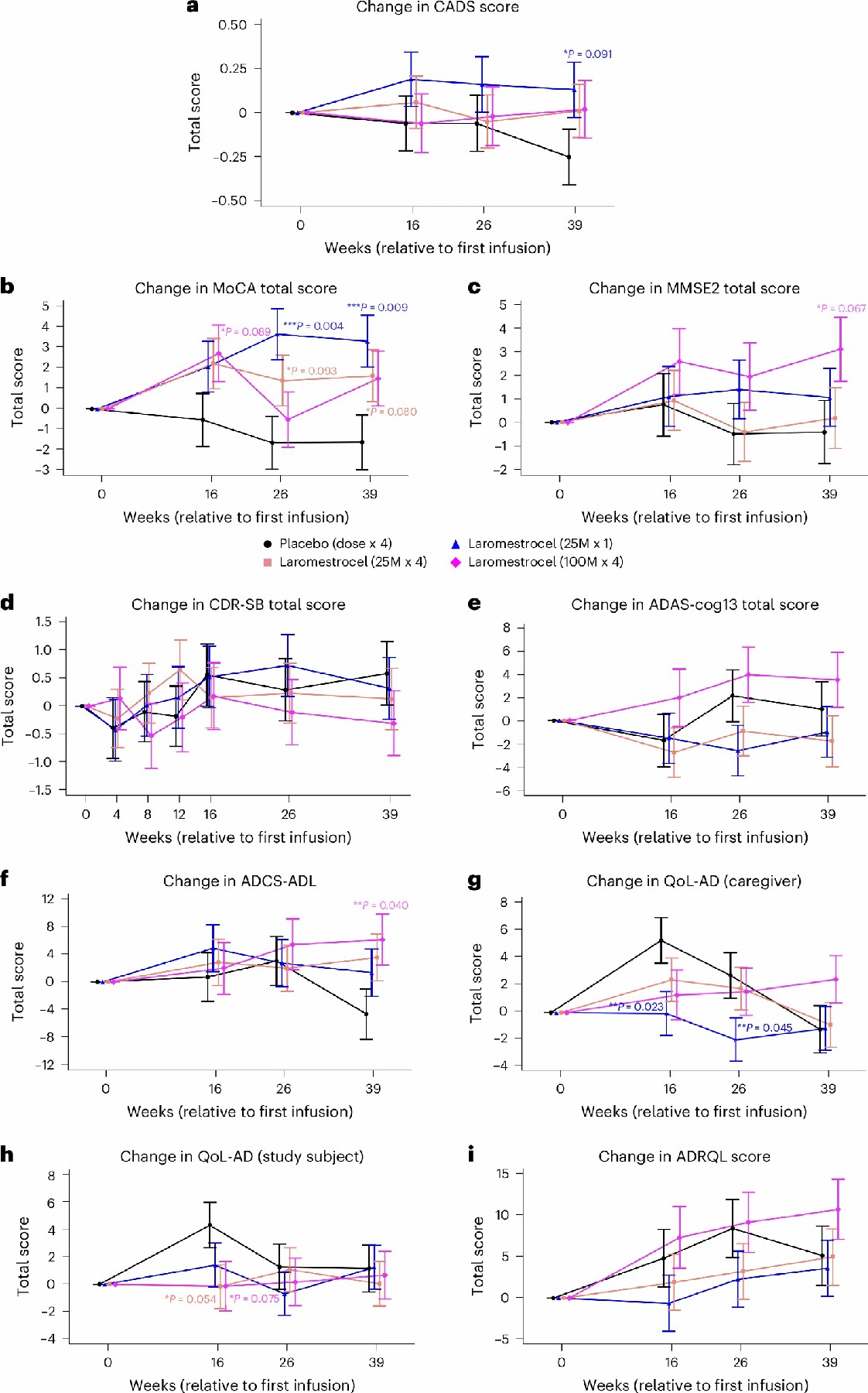
圖1:1-4 組采用顏色編碼:第 1 組(安慰劑;黑色)、第 2 組(25 M × 1;藍色)、第 3 組(25 M × 4;橙紅色)和第 4 組(100 M × 4;洋紅色)。從基線(CFB)到第 39 周的新型綜合阿爾茨海默病評分 (CADS) 的變化。
減緩腦萎縮:在腦萎縮方面,laromestrocel 治療效果顯著。與安慰劑組相比,所有治療組聯(lián)合(第 2 – 4 組)在 39 周時全腦體積萎縮減緩了 48.4%,左側海馬體體積萎縮減緩了 61.9%。多個腦區(qū),如顳葉、額葉等的萎縮也得到了明顯改善。
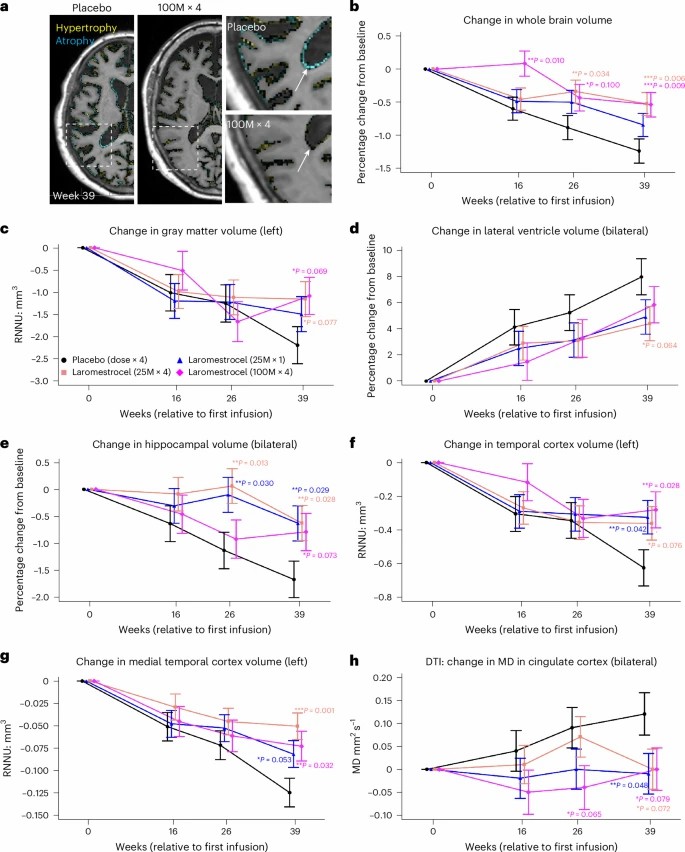
圖2:使用 laromestrocel 與使用安慰劑治療的 AD 患者的體積 MRI 評估。
減輕神經(jīng)炎癥:通過擴散張量成像(DTI)測量發(fā)現(xiàn),laromestrocel 治療組的扣帶回皮質平均擴散率(MD)降低,表明神經(jīng)炎癥減輕,其中第 2 組與安慰劑組相比差異具有統(tǒng)計學意義。
血清生物標志物變化:研究還檢測了血清生物標志物,發(fā)現(xiàn)安慰劑組中可溶性 TIE2(sTIE2)水平逐漸升高,而 laromestrocel 治療組中 sTIE2 水平在治療期間顯著降低,這表明 laromestrocel 可能通過調節(jié) TIE2 信號通路發(fā)揮促血管生成和抗炎作用。(圖3)
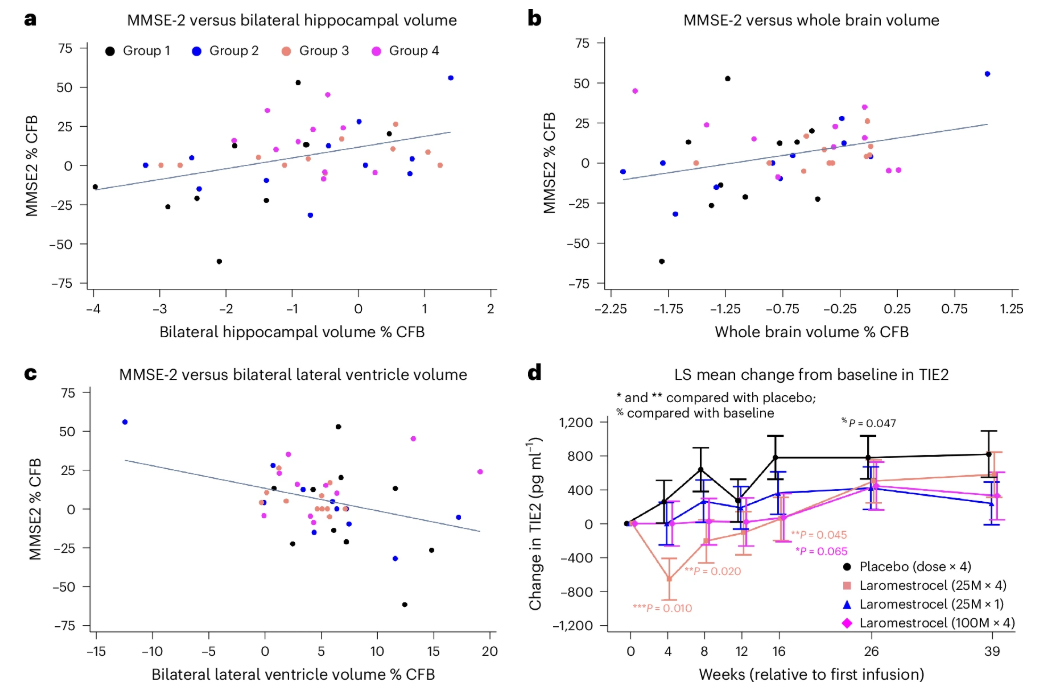
圖3:a、b、Pearson 相關性分析顯示第 39 周時雙側海馬(a)和整個大腦(b)萎縮減少與 MMSE-2 評分改善之間的相關性。
雙側腦室擴大減少與 MMSE-2 評分改善之間的相關性也很明顯(c)。在指定時間點收集的血清通過 Meso Scale Discovery (MSD) 分析 TIE2(d)。
安全性卓越:無 ARIA,耐受性良好
研究達到了主要終點,即安全性終點。在任何一次輸液后 4 周內,4 組患者中出現(xiàn)治療期間嚴重不良事件(TE-SAE)的比例相似:第 1 組為 0%;第 2 組為 7.7%;第 3 組為 7.7%;第 4 組為 9.1%。
所有 TE-SAE 均與患者的既往疾病相關,與研究產品無關且均已解決。此外,試驗中未觀察到輸液相關反應、超敏反應或 ARIAs,laromestrocel 在單劑量和多劑量給藥方案中均表現(xiàn)出良好的耐受性。
總結與展望
這項 2a 期研究進一步證實了 laromestrocel 治療輕度 AD 的安全性,無論是單劑量還是多劑量給藥。同時,研究也初步顯示出其在改善認知功能、生活質量和減緩腦萎縮方面的療效。與現(xiàn)有抗淀粉樣蛋白抗體治療相比,laromestrocel 不存在 ARIAs 風險,為 AD 治療開辟了新的方向。
不過,該研究也存在一些局限性,如樣本量較小、研究持續(xù)時間較短、CADS 評分尚未經(jīng)過驗證等。未來,還需要開展更大規(guī)模、更長時間的研究,進一步明確 laromestrocel 的安全性和有效性,探索其最佳治療方案,期待這種療法能早日為廣大阿爾茨海默癥患者帶來更有效的治療選擇。
參考資料:https://www.nature.com/articles/s41591-025-03559-0#Sec2
免責說明:本文僅用于傳播科普知識,分享行業(yè)觀點,不構成任何臨床診斷建議!杭吉干細胞所發(fā)布的信息不能替代醫(yī)生或藥劑師的專業(yè)建議。
版權說明:本文來自杭吉干細胞科技內容團隊,歡迎個人轉發(fā)至朋友圈,謝絕媒體或機構未經(jīng)授權以任何形式轉載至其他平臺,轉載授權請在網(wǎng)站后臺下方留言獲取。



 掃碼添加官方微信
掃碼添加官方微信