2024年12月27日,由澳大利亞伍倫貢大學(xué)聯(lián)合馬來西亞吉隆坡IMU大學(xué)干細胞研究中心在國際期刊《Biomedicines》上發(fā)表了一篇名為《干細胞療法治療肌萎縮側(cè)索硬化癥:間充質(zhì)干細胞、神經(jīng)干細胞和誘導(dǎo)多能干細胞療效的比較》的研究成果。
研究評估了間充質(zhì)干細胞(MSCs)、神經(jīng)干細胞(NSCs)和誘導(dǎo)多能干細胞(iPSCs)三種干細胞類型在漸凍癥(ALS)治療中的療效,為探索更有效的ALS干預(yù)手段提供了新思路。

干細胞療法治療漸凍癥:間充質(zhì)、誘導(dǎo)多能與神經(jīng)干細胞哪種效果更好?如何選擇?
一、為何漸凍癥始終難以治療?
漸凍癥(ALS)是一種以運動神經(jīng)元進行性退變?yōu)樘卣鞯闹旅陨窠?jīng)系統(tǒng)疾病。隨著運動神經(jīng)元不斷死亡,患者將逐漸喪失運動、言語、吞咽及呼吸功能。
目前獲批的藥物雖能在一定程度上延緩疾病進程,但無法阻止神經(jīng)元的持續(xù)損傷,更難以修復(fù)已受損的神經(jīng)結(jié)構(gòu)。正因如此,具備“神經(jīng)保護、損傷修復(fù)乃至細胞替代”潛能的干細胞療法,已成為該領(lǐng)域備受關(guān)注的研究焦點。
二、三種干細胞,三條不同的治療路徑
干細胞因具備自我更新、多向分化以及分泌調(diào)節(jié)等生物學(xué)特性,為漸凍癥(ALS)的治療提供了多種潛在干預(yù)思路。目前,在相關(guān)研究中受到重點關(guān)注的主要有三類干細胞,它們在治療策略和作用重點上各不相同:
1. 間充質(zhì)干細胞(MSCs):間充質(zhì)干細胞主要通過分泌多種活性因子發(fā)揮作用,具有抗炎、免疫調(diào)節(jié)和神經(jīng)保護等效應(yīng)。其核心優(yōu)勢在于改善神經(jīng)微環(huán)境、減輕繼發(fā)性損傷,從而為殘存運動神經(jīng)元提供相對有利的生存條件。
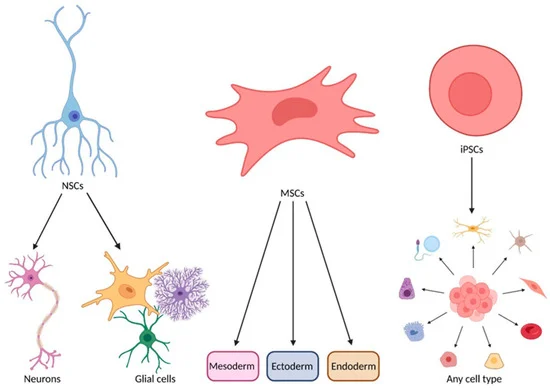
2. 神經(jīng)干細胞(NSCs):神經(jīng)干細胞來源于中樞神經(jīng)系統(tǒng)本身,具備分化為神經(jīng)元和神經(jīng)膠質(zhì)細胞的能力。相較其他類型干細胞,NSCs在理論上更接近“直接替代受損運動神經(jīng)元”的治療思路,因此被認為是更具針對性的干預(yù)手段。
3. 誘導(dǎo)多能干細胞(iPSCs):誘導(dǎo)多能干細胞具有高度分化潛能,理論上可生成多種神經(jīng)相關(guān)細胞類型,兼具細胞替代和環(huán)境支持的雙重作用。但受制于制備復(fù)雜度、成本及安全性評估等因素,目前仍主要停留在實驗研究和早期探索階段。
盡管這些研究不斷推進,但目前對于哪種干細胞在治療漸凍癥中效果更優(yōu)、更實用,仍存在不同看法。
那么,哪一種策略更有前景?接下來,我們將深入剖析這三類干細胞的臨床應(yīng)用現(xiàn)狀。
三、間充質(zhì)干細胞(MSCs):臨床經(jīng)驗最豐富的支持性療法
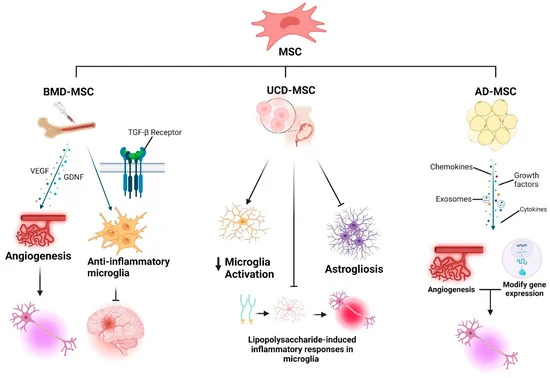
間充質(zhì)干細胞是當前漸凍癥干細胞治療中研究最深入、臨床應(yīng)用經(jīng)驗最豐富的一類。它們主要起“支持與保護”作用,通過分泌多種活性物質(zhì),為受損的神經(jīng)細胞創(chuàng)造生存和修復(fù)的環(huán)境。
機制層面,間充質(zhì)干細胞主要是通過分泌血管內(nèi)皮生長因子(VEGF)和膠質(zhì)細胞源性神經(jīng)營養(yǎng)因子(GDNF),促進血管生成并支持運動神經(jīng)元存活;同時釋放TGF-β,促使小膠質(zhì)細胞由促炎狀態(tài)轉(zhuǎn)向抗炎狀態(tài),從而減輕神經(jīng)炎癥、維持中樞神經(jīng)系統(tǒng)穩(wěn)態(tài)。
其整體作用更偏向于“改善病理環(huán)境、保護殘存神經(jīng)元”,而非直接替代神經(jīng)元。
臨床研究方面:
目前研究主要聚焦于三種來源的間充質(zhì)干細胞,各有優(yōu)勢:
- 骨髓來源(BM-MSCs):研究最久,臨床數(shù)據(jù)相對較多。可通過腰穿(鞘內(nèi)注射)回輸,在臨床研究中顯示出減緩疾病進展、可能延長生存期的潛力。但效果存在個體差異,且細胞活性會隨供者年齡增長而下降。
- 脂肪來源(AD-MSCs):易于獲取、數(shù)量豐富。其核心治療物質(zhì)“分泌組”(尤其是其中的外泌體)在動物實驗中能有效改善運動功能、保護神經(jīng)接頭。鼻內(nèi)給藥等新途徑也顯示出精準靶向的潛力,但人體療效尚需嚴格驗證。
- 臍帶來源(UC-MSCs):細胞年輕、增殖能力強。其培養(yǎng)液或經(jīng)基因改造后(如過表達BDNF)的細胞,在動物模型中能顯著延長壽命、減輕炎癥。早期回顧性臨床分析提示其可能有助延長患者生存時間,前景廣闊。
下表匯總了目前幾項具有代表性的間充質(zhì)干細胞治療漸凍癥的人體臨床試驗結(jié)果。
| 研究階段 | 入組人數(shù) | 給藥方式 | 給藥方案 | 主要研究結(jié)果 |
|---|---|---|---|---|
| I期 | 15人 | 鞘內(nèi)注射(腰椎) | 每3個月1次,共3次 | 病情進展較快患者進展速度減緩;進展較慢患者變化不明顯 |
| I/II期 | 157人 | 鞘內(nèi)注射 | 2次注射,或多次加強注射(3–10次) | 治療組生存率更高、死亡風(fēng)險更低;多次注射效果優(yōu)于少次;一年內(nèi)未見嚴重不良反應(yīng) |
| I/IIa期 | 20人 | 靜脈輸注 | 2×10? 個細胞/kg | 出現(xiàn)個別嚴重不良事件;5名患者在5年隨訪中仍存活 |
| III期 | 196人 | 鞘內(nèi)注射 | 共3次給藥 | 總體安全性可控;腦脊液中炎癥和神經(jīng)退行相關(guān)指標改善 |
| III期(進行中) | 約115人 | 腰椎穿刺(L2–L4) | 按體重給藥,共5次 | 尚未公布結(jié)果;預(yù)計2026年完成,隨后進行長期隨訪 |
四、神經(jīng)干細胞(NSCs):更貼近疾病本質(zhì)的修復(fù)策略
神經(jīng)干細胞(NSCs)被寄予厚望,其核心治療思路是“直接替換”:將具有分化潛能的干細胞移植到患者體內(nèi),以期直接生長為新的、健康的運動神經(jīng)元,替代那些已經(jīng)損壞的細胞,從而從根源上嘗試修復(fù)神經(jīng)功能。
作用機制方面,NSCs更偏向于“結(jié)構(gòu)性修復(fù)”。
- 一方面,它們可在脊髓微環(huán)境中存活并分化為支持性神經(jīng)膠質(zhì)細胞,分泌多種神經(jīng)營養(yǎng)因子,為運動神經(jīng)元提供局部保護;
- 另一方面,部分研究顯示,NSCs能夠在脊髓節(jié)段內(nèi)有限遷移,與周圍神經(jīng)組織建立聯(lián)系,從而延緩神經(jīng)元退變。
這種作用模式更接近“補充與替代受損細胞”,而不僅是改善炎癥或代謝環(huán)境。
臨床研究方面:
NSCs的探索起步較早,重點集中在安全性和可行性。多項I期臨床試驗采用脊髓內(nèi)注射hNSCs,隨訪時間最長達5年,結(jié)果顯示總體耐受性良好,未發(fā)現(xiàn)明顯的長期并發(fā)癥或醫(yī)源性神經(jīng)損傷。在部分患者中,觀察到運動功能穩(wěn)定或輕度改善。
此外為彌補NSCs自身分泌能力和作用范圍有限的問題,基因修飾神經(jīng)祖細胞成為新的研究方向。
例如,工程化表達膠質(zhì)細胞源性神經(jīng)營養(yǎng)因子(GDNF)的NSC衍生細胞,在臨床研究中表現(xiàn)出良好的安全性,并在尸檢中證實可長期存活并持續(xù)分泌神經(jīng)營養(yǎng)因子,患者出現(xiàn)疾病進展減緩的跡象。
下面表格是幾項關(guān)鍵神經(jīng)干細胞治療漸凍癥人體臨床試驗的總結(jié)。
| 研究階段 | 入組人數(shù) | 給藥方式 | 主要結(jié)論 |
|---|---|---|---|
| I 期 | 12 人 | 腰段脊髓內(nèi)注射(單側(cè)或雙側(cè)) | 未發(fā)現(xiàn)長期嚴重并發(fā)癥;患者疾病進展放緩 |
| I 期 | 18 人 | 脊髓灰質(zhì)內(nèi)微量注射(腰段/頸段) | 隨訪最長5年安全性良好;部分患者進展減緩 |
| II 期 | 15 人 | 頸段±腰段雙側(cè)注射,劑量遞增 | 未加速疾病進展;ALSFRS-R和生存評分改善 |
| I/IIa 期 | 18 人 | 腰段脊髓內(nèi)單側(cè)注射 | 隨訪3–4年未見運動功能惡化;安全性可接受 |
五、誘導(dǎo)多能干細胞(iPSCs):潛力巨大但仍處探索階段
誘導(dǎo)多能干細胞(iPSCs)的核心治療思路是“個體化再生替代”。它來源于患者自身的體細胞,經(jīng)重編程后獲得多向分化能力,理論上可分化為運動神經(jīng)元及多種膠質(zhì)細胞,用于補充 ALS中不斷丟失的神經(jīng)細胞,從源頭嘗試修復(fù)神經(jīng)功能。
在作用機制上,iPSCs兼具“直接替代+環(huán)境支持”雙重作用。
- 一方面,iPSC衍生的運動神經(jīng)元在動物模型中可形成神經(jīng)肌肉接頭,改善軸突再生和神經(jīng)傳導(dǎo);
- 另一方面,這些細胞還能分泌神經(jīng)營養(yǎng)因子和抗炎因子,改善神經(jīng)微環(huán)境,支持殘存神經(jīng)元存活,延緩疾病進展。
在研究與臨床進展方面:目前iPSC在ALS中仍以臨床前研究和早期探索為主。
動物實驗結(jié)果較為積極,顯示出神經(jīng)保護和功能改善潛力;但人體研究樣本量有限,療效仍需更多臨床試驗驗證。同時,制備成本高、工藝復(fù)雜及基因安全性問題,是其進一步臨床轉(zhuǎn)化的主要限制。
六、這三種干細胞,哪一種治療漸凍癥的效果最好?
簡單來說,如果在這三種干細胞療法中做一個更有針對性的選擇,神經(jīng)干細胞更值得重點關(guān)注。
原因在于,漸凍癥的本質(zhì)是運動神經(jīng)元不斷死亡。神經(jīng)干細胞本身就屬于中樞神經(jīng)系統(tǒng)細胞,能夠分化為神經(jīng)元和神經(jīng)膠質(zhì)細胞,有機會直接參與修復(fù)受損的神經(jīng)結(jié)構(gòu),作用更“對癥”。
相比之下,間充質(zhì)干細胞主要是抗炎和保護現(xiàn)有神經(jīng)元,更像“托底治療”,對已經(jīng)發(fā)生明顯神經(jīng)元丟失的患者修復(fù)能力有限;誘導(dǎo)多能干細胞潛力很大,但目前仍以實驗研究為主,距離成熟臨床應(yīng)用還有距離。
因此,在現(xiàn)階段,從機制匹配度、臨床可行性和實際修復(fù)潛力綜合考慮,神經(jīng)干細胞是三者中效果更有希望、也更值得推薦的一類。
七、漸凍癥患者該如何選擇?
對于漸凍癥患者及家屬而言,面對不斷出現(xiàn)的干細胞新研究,最關(guān)心的問題往往不是“哪種技術(shù)最先進”,而是哪一種更安全、更現(xiàn)實、更適合當下階段的自己。
從現(xiàn)有證據(jù)來看,可以從以下幾個方面進行綜合考慮:
第一,安全性始終是首要前提
優(yōu)先關(guān)注已有較長隨訪時間、在多項臨床研究中未出現(xiàn)嚴重安全隱患的治療路徑。
例如,神經(jīng)干細胞和間充質(zhì)干細胞在臨床試驗中總體耐受性較好,而iPSCs目前仍主要停留在實驗研究階段,安全性和穩(wěn)定性尚需更多驗證。
第二,治療機制是否“對癥”
漸凍癥的核心問題是運動神經(jīng)元持續(xù)死亡。
從機制匹配度看,神經(jīng)干細胞具備向神經(jīng)元和神經(jīng)膠質(zhì)細胞分化的能力,有機會直接參與神經(jīng)結(jié)構(gòu)修復(fù),更貼近疾病本質(zhì);
而間充質(zhì)干細胞更適合作為輔助性支持治療,用于改善炎癥環(huán)境、延緩進展。
第三,疾病階段和個體差異
在疾病早期或進展較快階段,保護殘存神經(jīng)元、減緩惡化速度尤為重要;而在神經(jīng)元大量丟失后,是否具備“替代和重建”潛力則更值得關(guān)注。
這意味著,不同階段的患者,適合的治療策略并不完全相同。
第四,務(wù)必選擇合規(guī)、可追溯的醫(yī)療機構(gòu)
干細胞治療涉及細胞來源、制備工藝、給藥方式和長期隨訪,必須在具備相應(yīng)資質(zhì)的醫(yī)療或科研機構(gòu)中進行。
結(jié)語
總體來看,這項系統(tǒng)比較研究為干細胞治療漸凍癥提供了更清晰的認知框架。間充質(zhì)干細胞在安全性和抗炎保護方面已積累較多經(jīng)驗,誘導(dǎo)多能干細胞代表著未來個體化再生醫(yī)學(xué)的方向,而神經(jīng)干細胞則在作用機制上與漸凍癥的核心病理最為契合,展現(xiàn)出更直接的修復(fù)潛力。
雖然未來,干細胞治療仍處于持續(xù)探索階段,尚不能替代現(xiàn)有規(guī)范治療。但隨著臨床試驗規(guī)模擴大、給藥方式和細胞工程技術(shù)不斷優(yōu)化,干細胞療法有望為漸凍癥患者帶來更切實、可及的治療選擇,也為這一“無藥可治”的疾病打開新的希望窗口。
信息來源:
Frawley, L.; Taylor, N.T.; Sivills, O.; McPhillamy, E.; To, T.D.; Wu, Y.; Chin, B.Y.; Wong, C.Y. Stem Cell Therapy for the Treatment of Amyotrophic Lateral Sclerosis: Comparison of the Efficacy of Mesenchymal Stem Cells, Neural Stem Cells, and Induced Pluripotent Stem Cells. Biomedicines 2025, 13, 35. https://doi.org/10.3390/biomedicines13010035
免責(zé)說明:本文僅用于傳播科普知識,分享行業(yè)觀點,不構(gòu)成任何臨床診斷建議!杭吉干細胞所發(fā)布的信息不能替代醫(yī)生或藥劑師的專業(yè)建議。如有版權(quán)等疑問,請隨時聯(lián)系我。



 掃碼添加官方微信
掃碼添加官方微信