近年來,干細胞療法已成為生物醫(yī)學領(lǐng)域最具顛覆性的研究方向之一。這類療法通過激活干細胞的多向分化潛能與免疫調(diào)節(jié)功能,為傳統(tǒng)藥物難以攻克的疾病(如遺傳缺陷、退行性疾病及癌癥)提供了全新的治療思路。
據(jù)統(tǒng)計,全球已有超過29款干細胞產(chǎn)品獲得監(jiān)管機構(gòu)批準,針對血液系統(tǒng)疾病、免疫紊亂及組織損傷等適應(yīng)癥,而目前正在開展的臨床試驗更逾800項,其中造血干細胞(HSC)與間充質(zhì)干細胞(MSC)因其獨特的生物學特性占據(jù)主導地位。
然而,盡管臨床前景廣闊,干細胞療法的轉(zhuǎn)化之路仍布滿荊棘。從細胞來源的標準化、體外擴增的效率瓶頸,到移植后存活率低、功能異質(zhì)性等科學挑戰(zhàn),再到監(jiān)管框架與倫理爭議的全球性分歧,每一環(huán)節(jié)均需突破性創(chuàng)新。
干細胞療法為何難落地?-從29款獲批產(chǎn)品到800項試驗背后的挑戰(zhàn)與突破
近期,美國馬薩諸塞州哈佛大學約翰·保爾森工程與應(yīng)用科學學院在期刊雜志《生物功能與轉(zhuǎn)換醫(yī)學主頁》上發(fā)表了一篇”Stem cell therapies in the clinic“的文獻綜述。

該綜述旨在系統(tǒng)梳理干細胞療法的臨床進展,通過分析已獲批產(chǎn)品與前沿臨床試驗數(shù)據(jù),揭示造血干細胞與間充質(zhì)干細胞的治療潛力與局限性,并重點探討加速其臨床轉(zhuǎn)化所需的多學科協(xié)作路徑。
科學奇跡還是現(xiàn)實曙光?干細胞療法的百年征程與未來猜想
細胞療法是一種通過移植活細胞材料來治療疾病的前沿醫(yī)學手段,其核心優(yōu)勢在于細胞能動態(tài)響應(yīng)生物信號、穿透生物屏障并可能通過單次治療實現(xiàn)長期療效。該療法起源于19世紀,現(xiàn)主要分為兩大方向:
- T細胞療法:以1986年首次癌癥過繼轉(zhuǎn)移治療為起點,歷經(jīng)30年發(fā)展已革新癌癥免疫治療。FDA已批準多種血液腫瘤療法,并擴展至實體瘤領(lǐng)域(如晚期黑色素瘤)。
- 干細胞療法:自1959年首例白血病骨髓移植起,逐步發(fā)展出造血干細胞移植(HSCT)和1976年發(fā)現(xiàn)的間充質(zhì)干細胞(MSC)技術(shù)。全球監(jiān)管機構(gòu)已建立相關(guān)標準,批準產(chǎn)品涉及多種疾病,但約80%療法仍處于早期臨床試驗階段,需解決制造工藝、安全性驗證及適應(yīng)癥擴展等挑戰(zhàn)。
我們首先回顧了幾十年來指導干細胞療法發(fā)展的歷史努力。接下來,我們確定了29種已獲準在各個國家用于臨床的干細胞療法產(chǎn)品和800項利用干細胞作為治療方式的活躍臨床試驗。
我們的分析僅限于以干細胞為主要治療成分的治療干預(yù),不包括主要關(guān)注干細胞以外方式的試驗和產(chǎn)品。
在我們的分析中,我們發(fā)現(xiàn)兩種不同類型的干細胞——造血干細胞 (HSC) 和間充質(zhì)干細胞 (MSC)——占獲批干細胞療法產(chǎn)品和臨床試驗的大多數(shù)(圖1)。幾種專門的干細胞和未純化的干細胞濃縮物僅占少數(shù)療法。
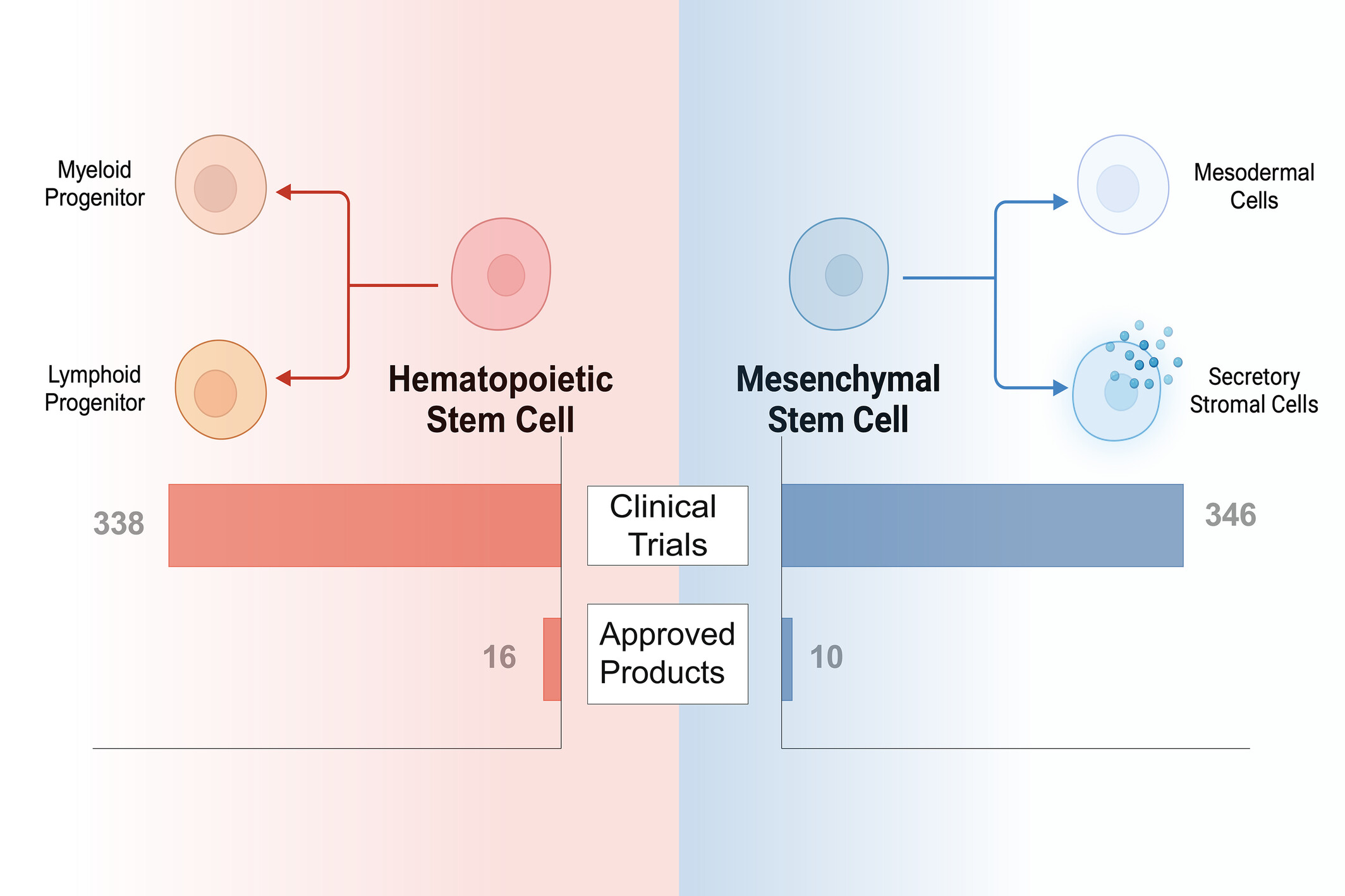
因此,我們根據(jù)干細胞類型組織討論。我們簡要概述了歷史發(fā)展,全面調(diào)查了獲批產(chǎn)品,對活躍的臨床試驗進行了批判性分析,并詳細分析了干細胞療法目前面臨的挑戰(zhàn)。這篇綜述是對我們過去對細胞療法的分析的更新,僅關(guān)注干細胞療法。
干細胞的背景-生物學及歷史發(fā)展
干細胞存在于胚胎和成年組織中,依發(fā)育潛能分為全能、多能、多能干細胞、寡能和單能細胞。
全能和胚胎多能干細胞因倫理受限。研究致力于將患者終末分化細胞轉(zhuǎn)化為誘導多能干細胞并用于治療,但誘導多能干細胞臨床研究尚處起步,占比小。當前臨床試驗主體是造血干細胞和間充質(zhì)干細胞等多能干細胞,本文綜述以此為主,也會涉及其他不常見干細胞類型。
什么是造血干細胞(HSCs):
- 功能與應(yīng)用:HSCs是能分化為血細胞的多能細胞,可通過重建血細胞或重編程免疫系統(tǒng)治療多種血液疾病。移植程序包括采集、純化和移植,部分情況會在體外修飾擴增。
- 發(fā)展歷程:始于20世紀50年代,早期因HLA不匹配患者死亡,70年代供體短缺,后通過自體外周血和異基因臍帶血方案解決。80年代可讓癌癥患者接受更高劑量放化療,但存在產(chǎn)品純度問題,為此開發(fā)了預(yù)處理和移植后調(diào)節(jié)方案,分MAC和RIC兩種類型,同時不斷優(yōu)化方案以平衡毒性和免疫消融。
- 臨床進展:多樣化干細胞來源、靈活的HLA匹配、溫和的調(diào)節(jié)方案、高純度制劑和改進的患者管理擴大了其適用范圍。自體用于減少GvHD并發(fā)癥,異基因用于免疫治療。美國相關(guān)法案要求報告異基因移植數(shù)據(jù),CIBMTR管理并分析數(shù)據(jù),為進一步發(fā)展提供基準。

什么是間充質(zhì)干細胞(MSCs):
- 功能與應(yīng)用:是能分化為中胚層細胞并調(diào)節(jié)免疫系統(tǒng)的多能細胞,可用于再生和免疫調(diào)節(jié),1995年首次用于患者。可從骨髓、脂肪、臍帶組織和胎盤等分離,能在體外培養(yǎng)擴增并分化為多種間充質(zhì)組織。
- 體內(nèi)應(yīng)用挑戰(zhàn)與益處:體內(nèi)應(yīng)用存在再生性能和植入率問題,但因分泌生物活性分子,通過抗凋亡和營養(yǎng)機制促進再生。
- 免疫調(diào)節(jié)機制:經(jīng)炎性因子刺激可分泌抗炎因子,用于免疫過度激活疾病,但免疫調(diào)節(jié)活性需特定預(yù)處理激活。
- 機械轉(zhuǎn)導作用:過去20年發(fā)現(xiàn)底物彈性和細胞微環(huán)境粘彈性可調(diào)節(jié) MSCs命運。盡管療效不一,但安全性佳,是治療多種疾病的多功能工具。
應(yīng)用現(xiàn)狀
- 典型臨床劑量為1-1.5億細胞,需特定預(yù)處理激活免疫調(diào)節(jié)功能。
- 盡管多數(shù)試驗處于早期階段,MSCs在組織修復(fù)和免疫疾病中的潛力持續(xù)推動臨床研究。
全球批準的細胞治療產(chǎn)品
雖然干細胞已在臨床上應(yīng)用了50多年,但定義明確、經(jīng)機構(gòu)批準的細胞產(chǎn)品直到2010年代才首次面世。首個經(jīng)機構(gòu)批準的干細胞療法是Queencell? (Anterogen),這是一種用于治療皮下組織缺損的MSC產(chǎn)品,于2010年獲得韓國食品藥品安全部 (SK MFDS) 的批準。在接下來的十年中,干細胞療法的臨床應(yīng)用顯著擴大,獲得了世界各地監(jiān)管機構(gòu)的多項批準(圖2)。
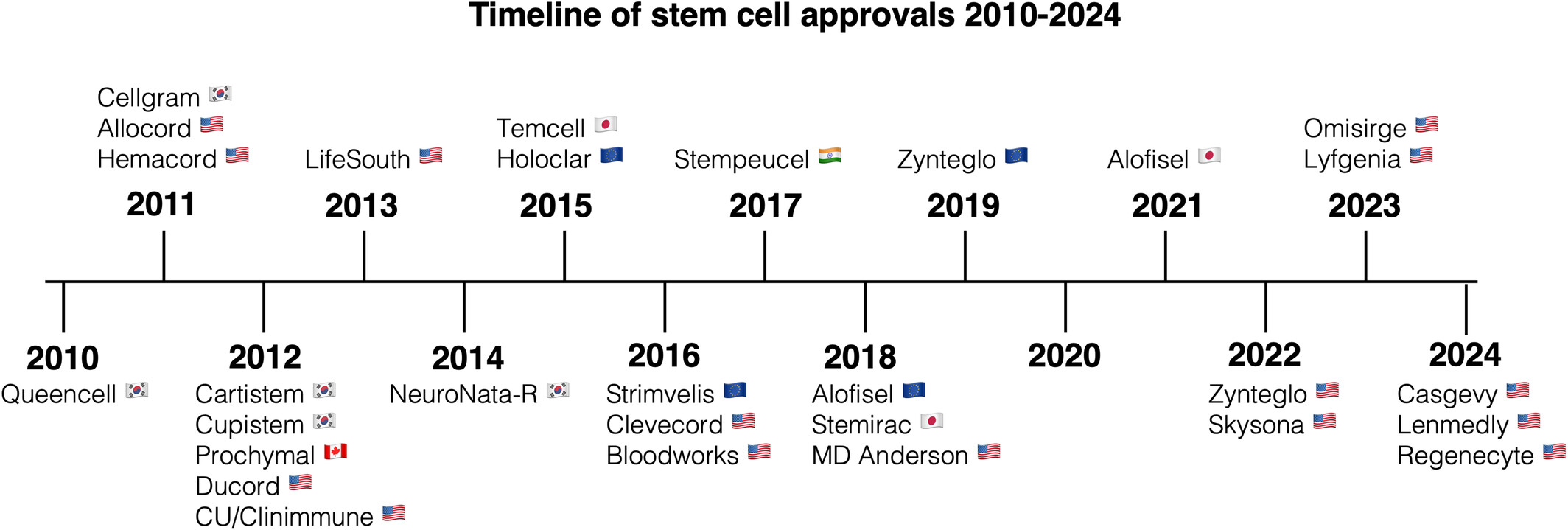
根據(jù)我們對文獻和政府數(shù)據(jù)庫的搜索,全球共有27種干細胞產(chǎn)品獲得29次批準,其中包括16種HSC產(chǎn)品、12種MSC產(chǎn)品和1種角膜緣干細胞 (LSC) 產(chǎn)品(圖3a)。干細胞類型、來源和批準適應(yīng)癥的變化似乎與區(qū)域趨勢相關(guān)(圖3b)。
更正:目前應(yīng)該是29款干細胞產(chǎn)品。
- 28:間充質(zhì)干細胞新藥時代來臨!美國首款間充質(zhì)干細胞(MSC)產(chǎn)品獲FDA批準!
- 29:2025年1月2日,CCTV13新聞報道了一則振奮人心的重磅消息——我國首款干細胞治療藥品正式獲批上市!
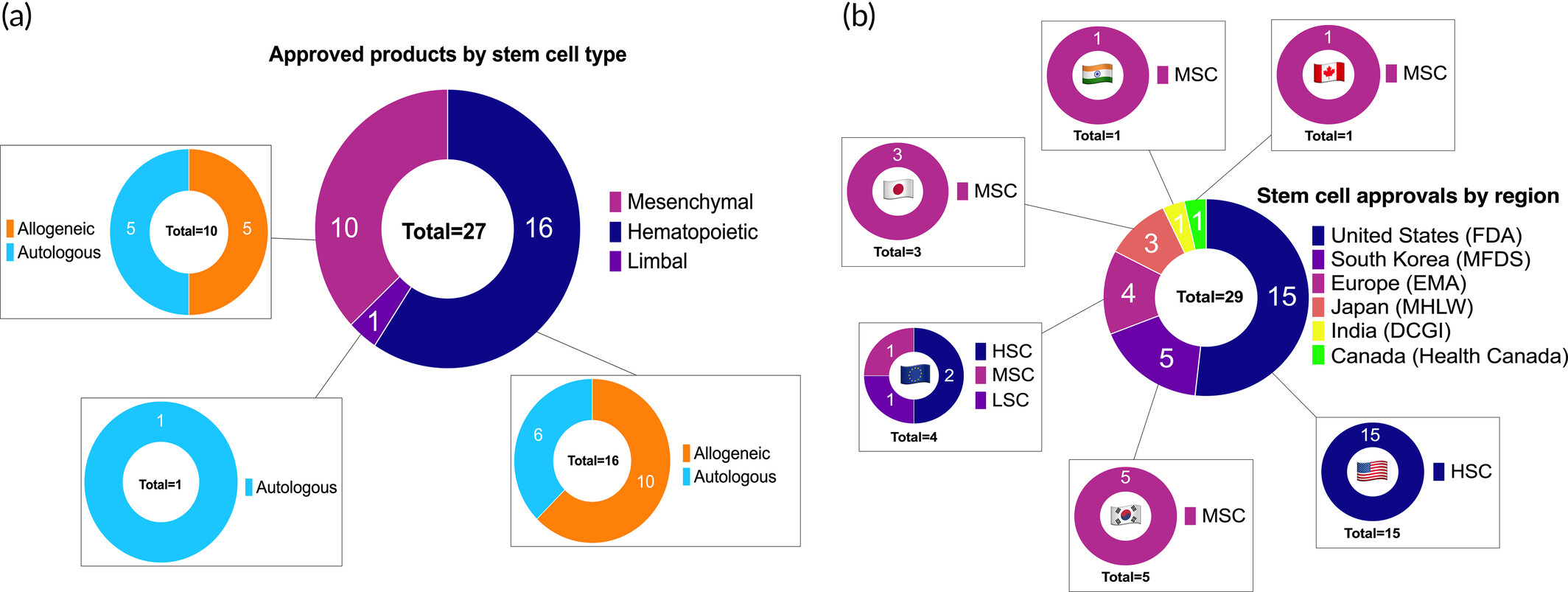
(a)按干細胞類型對已批準產(chǎn)品進行分類。(b)按地區(qū)對干細胞批準進行分類。
已批準的造血干細胞產(chǎn)品
截至2024年11月,美國(FDA)和歐洲(EMA)共批準16種HSC療法產(chǎn)品,其中:1種獲FDA和EMA雙重批準,14種僅獲FDA批準,1種僅獲EMA批準。值得注意的是,盡管全球每年開展數(shù)萬例造血干細胞移植(HSCT),但僅有FDA和EMA對HSC產(chǎn)品進行正式監(jiān)管審批。
全球造血干細胞移植的應(yīng)用趨勢
- 規(guī)模:1957至2019年全球累計完成150萬例HSCT,且異移植比例持續(xù)上升。
- 區(qū)域分布:美歐年移植量超7萬例(美國2萬+/歐洲近5萬),仍為最大市場。非洲、東地中海等資源有限地區(qū)HSCT增速最快,尤其在急性髓系白血病治療中表現(xiàn)顯著。
監(jiān)管標準與豁免條件
根據(jù)FDA規(guī)定,符合以下條件的HSC療法無需審批:
- 最小化處理:未涉及細胞工程或制造工藝改變(如常規(guī)骨髓移植)。
- 同源用途:用于重建原有功能(如造血系統(tǒng)再生)。
反之,經(jīng)工程改造或復(fù)雜工藝的HSC產(chǎn)品需接受嚴格質(zhì)控與安全審查。
創(chuàng)新造血干細胞產(chǎn)品案例
功能增強型
- Omisirge?(Gamida Cell,2023年獲批):煙酰胺體外擴增HSC,縮短中性粒細胞恢復(fù)時間并降低感染風險。
基因改造型
- Zynteglo? & Lyfgenia?(Bluebird Bio):慢病毒載體修復(fù)β-珠蛋白基因,治療血紅蛋白病。
- SKYSONA?(Bluebird Bio,2022年):治療兒童腦腎上腺腦白質(zhì)營養(yǎng)不良(CALD)。
- Lenmedly?(Orchard Therapeutics,2024年):治療異染性腦白質(zhì)營養(yǎng)不良(MLD)。
- REGENECYTE(StemCyte Inc.,2024年11月獲批):臍帶血HSC療法,用于造血與免疫系統(tǒng)重建。
已批準的間充質(zhì)干細胞與角膜緣產(chǎn)品
間充質(zhì)干細胞(MSC)產(chǎn)品
目前全球已有12項間充質(zhì)干細胞產(chǎn)品獲得13次批準
- 美國FDA(1項):2024年12月18日,美國食品藥品管理局(FDA)正式批準了首個間充質(zhì)基質(zhì)細胞(MSC)療法——Ryoncil(remestemcel-L-rknd),用于治療2個月及以上兒科患者的類固醇難治性急性移植物抗宿主病(SR-aGVHD)。
- 其他國家:共批準12種MSC產(chǎn)品,主要分布于:
- 亞洲(占90%):韓國(5)、日本(3)、中國(1)、印度(1)
- 歐美:歐洲(1)、加拿大(1)
間充質(zhì)干細胞新藥適應(yīng)癥分類
獲批MSC產(chǎn)品覆蓋四大治療領(lǐng)域:
- 軟組織再生(如Queencell?、Cupistem?)
- 骨關(guān)節(jié)炎(如Cartistem?、Stempeucel?)
- 中樞神經(jīng)系統(tǒng)疾病(如NeuroNata-R?治療漸凍癥、Stemirac治療脊髓損傷)
- 移植物抗宿主病(GvHD)(如Prochymal?、TEMCELL?)
間充質(zhì)干細胞新藥來源分析
- 骨髓來源(8/12):自體(Cellgram?)與異體(Prochymal?)均有,適應(yīng)癥覆蓋全部四類。
- 脂肪來源(3/12):僅用于軟組織再生(如Queencell?)。
- 臍帶血來源(1/12):Cartistem?用于骨關(guān)節(jié)炎軟骨修復(fù)。
角膜緣干細胞(LSC)產(chǎn)品:里程碑突破
- Holoclar?(2015年EMA批準):全球首個獲批的干細胞療法,用于治療角膜緣干細胞缺陷癥(如化學燒傷致盲)。
- 技術(shù)核心:取自患者健康角膜緣的1-2mm2活檢樣本,經(jīng)人纖維蛋白支架體外擴增后移植,重建透明無血管角膜。
- 臨床價值:為角膜再生提供精準解決方案,標志著眼科再生醫(yī)學的實質(zhì)性進展。
- 現(xiàn)狀與展望:LSC療法仍處于早期階段,Holoclar?是唯一獲批產(chǎn)品,但其成功為其他眼科適應(yīng)癥(如干眼癥、角膜潰瘍)奠定技術(shù)基礎(chǔ)。
未來需解決規(guī)模化生產(chǎn)、長期安全性驗證及成本可及性問題。
總結(jié)對比
| 干細胞類型 | 獲批產(chǎn)品數(shù) | 核心適應(yīng)癥 | 技術(shù)成熟度 |
|---|---|---|---|
| HSC | 16(美歐) | 血液疾病、免疫重建 | 高度成熟 |
| MSC | 12(日韓中美) | 軟組織修復(fù)、GvHD等 | 中低成熟 |
| LSC | 1(歐洲) | 角膜再生 | 新興領(lǐng)域 |
正在進行的造血干細胞、間充質(zhì)干細胞的臨床試驗
研究人員通過系統(tǒng)檢索“ClinicalTrials.gov”數(shù)據(jù)庫,以“干細胞”“HSC”“MSC”為關(guān)鍵詞,篩選出狀態(tài)為 “尚未招募”“正在招募”“正在進行但不招募”“邀請招募” 的干預(yù)性研究,經(jīng)人工篩選確定了800項將干細胞作為主要治療成分的臨床試驗。
隨后從干細胞類型(圖4a)、試驗階段(圖4b)、試驗狀態(tài)(圖4c)、細胞來源(圖4d)、給藥方式和適應(yīng)癥等方面對這些試驗進行詳細分析。為避免重復(fù)計數(shù),對于跨多個疾病類別的適應(yīng)癥只歸入一個類別,但承認這種分類在數(shù)據(jù)分析中存在不一致性。
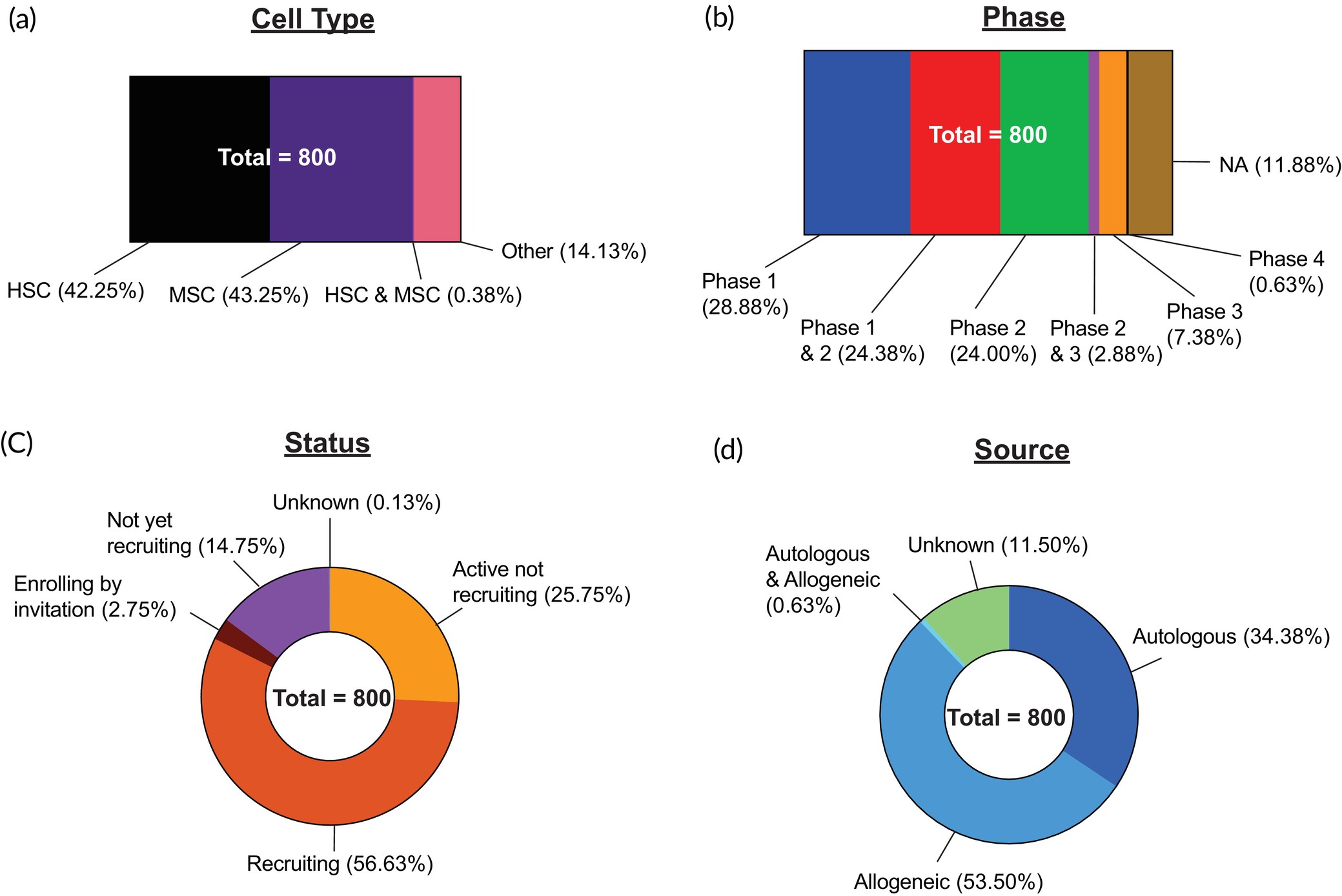
對800項干細胞臨床試驗進行了分析,并根據(jù)以下標準進行分類:(a) 細胞類型;(b) 試驗階段;(c) 試驗狀態(tài);(d) 細胞來源。不適用 (NA)。
臨床試驗分為不同階段,每個階段的目的不同:
- 第1階段-在小群體(20-80人)中研究治療的安全性和副作用;
- 第2階段-在大群體(100-300人)中確定治療的有效性;
- 第3階段-確認有效性、監(jiān)測副作用,并將治療與既定標準進行比較;
- 第4階段-在藥物批準后跟蹤安全性并尋求有關(guān)該藥物的更多信息。
在分析的800項活躍試驗中,HSC(n?=338,42.25%)和MSC(n=346,43.25%)的試驗數(shù)量幾乎相等。就細胞來源而言,53.50%為同種異體,而34.38%為自體。
造血干細胞(HSC)臨床試驗的新興趨勢
在分析的臨床試驗中,42.3%(n=338)涉及造血干細胞(HSC)的應(yīng)用。其中,44%處于臨床Ⅰ期,34%處于臨床Ⅱ期,僅10%進入臨床Ⅲ期(圖5a)。盡管HSC已廣泛用于治療多種疾病,但早期階段試驗的主導地位表明學界對推進HSC向下一代療法發(fā)展的強烈興趣。這些早期試驗包括探索新型藥物與HSC移植協(xié)同作用的可能性。
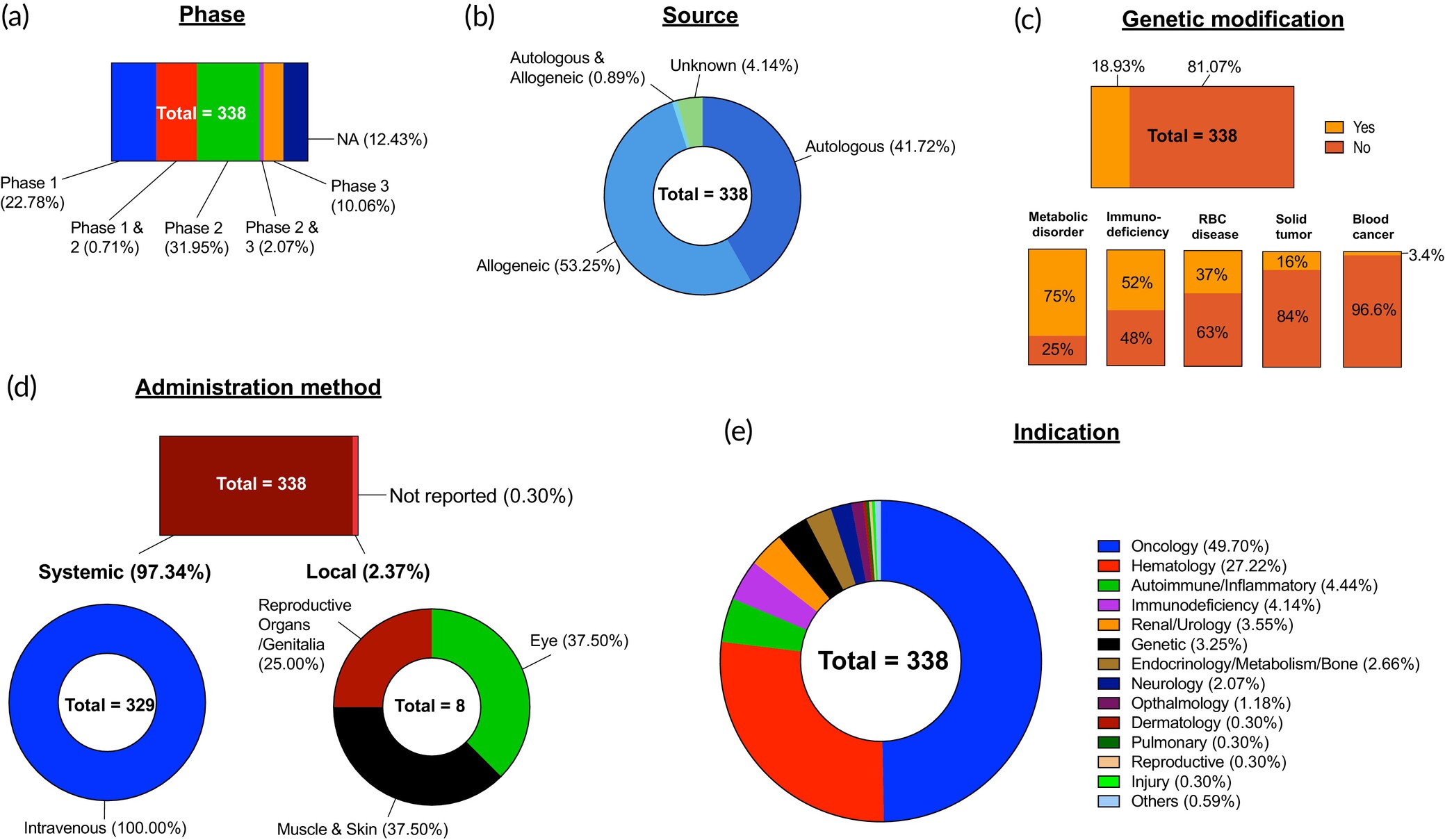
對338項HSC臨床試驗進行了分析,并根據(jù)以下方面進行了分類:(a) 試驗階段;(b) 細胞來源;(c) 基因改造;(d) 給藥方法,進一步分為全身和局部途徑;(e) 適應(yīng)癥類型。不適用 (NA)。
預(yù)移植聯(lián)合方案旨在優(yōu)化靶向清除特定免疫細胞(如T細胞、B細胞)的藥物選擇,而移植后聯(lián)合方案則利用現(xiàn)有免疫調(diào)節(jié)劑控制基礎(chǔ)疾病并支持移植后急性期的植活。涉及的藥物/技術(shù)包括:
- 預(yù)處理期免疫耗竭抗體(如抗CD3抗體NCT00319657、抗CD45抗體NCT03670966)
- 體外T/B細胞去除裝置(如NCT03653338、NCT02061800)
- 移植后免疫調(diào)節(jié)劑(如PD-1抑制劑NCT05137886、抗CD38抗體NCT04268498等)
- 免疫細胞療法(如T細胞NCT05239676、NK細胞NCT05654038)
- 樹突狀細胞疫苗(如NCT03334305)
這一研究熱潮源于近期發(fā)現(xiàn):通過選擇性清除供體HSC和受體患者體內(nèi)的適應(yīng)性免疫細胞(如B/T細胞),可預(yù)防急性和慢性移植物抗宿主病(GvHD),從而減少移植后免疫抑制的需求,并允許采用更溫和甚至無毒的預(yù)處理方案,顯著改善患者生活質(zhì)量。
造血干細胞創(chuàng)新應(yīng)用探索
部分早期試驗正拓展HSC的傳統(tǒng)適應(yīng)癥范圍,包括:
- 精神疾病:如酒精相關(guān)抑郁癥(NCT03265808)
- 器官移植耐受:肺(NCT03500731)、腎移植(NCT00319657)
- 腫瘤靶向治療:通過基因修飾HSC靶向?qū)嶓w瘤標志物(如NY-ESO-1;NCT03240861)、抵抗HIV感染(NCT02797470)、化療耐藥(P140K MGMT;NCT05052957)
- 精準遞送:腫瘤特異性細胞因子遞送(NCT03866109)
- 再生醫(yī)學:修復(fù)缺血性或退化性視網(wǎng)膜病變(NCT03981549)
造血干細胞的臨床Ⅲ期試驗特點
僅有10%的HSC試驗進入臨床Ⅲ期,其中:
- 82%聚焦于血液系統(tǒng)疾病(如白血病、代謝紊亂、遺傳性血液病),部分療法已獲批;
- 18%探索非傳統(tǒng)適應(yīng)癥,包括眼癌(NCT00554788)、腦癌(NCT00085202)、乳腺癌(NCT01646034)及腎移植排斥(NCT03363945)。
療效終點因疾病類型和試驗設(shè)計差異顯著,主要包括:
- 毒性指標:GvHD嚴重程度、劑量限制性毒性、治療中斷率;
- 有效性指標:移植物排斥率、植活率、微小殘留病陰性率、復(fù)發(fā)率、無進展生存期等。
目前,HSC臨床試驗的終點設(shè)定復(fù)雜多樣,跨階段、跨疾病的系統(tǒng)性趨勢分析面臨挑戰(zhàn)。
HSC臨床試驗呈現(xiàn)兩大方向:
- 優(yōu)化現(xiàn)有療法:通過新型免疫調(diào)節(jié)策略減少GvHD風險,提升患者生存質(zhì)量;
- 拓展適應(yīng)癥:探索其在腫瘤免疫治療、器官移植耐受及再生醫(yī)學中的潛力。
臨床Ⅲ期研究仍集中在血液系統(tǒng)疾病,但實體瘤和器官排斥領(lǐng)域的突破性應(yīng)用值得關(guān)注。
造血干細胞療法的來源
在分析的臨床試驗中,異體HSCT(53.3%,n=338)略多于自體HSCT(41.7%,圖5b),這與當前臨床實踐(自體HSCT更常用)形成鮮明對比。然而,隨著無關(guān)供體注冊數(shù)量的增加,異體HSCT可能在臨床中逐漸超越自體HSCT。
供體類型的選擇不僅涉及物流問題,還直接影響治療效果:
- 異體HSCT可通過移植物抗宿主反應(yīng)(GvHD)靶向受體體內(nèi)的惡性細胞(如白血病細胞),對癌癥患者產(chǎn)生免疫治療效應(yīng),或?qū)ψ陨砻庖卟』颊弋a(chǎn)生免疫抑制效應(yīng)。
- 自體HSCT因耐受性好,主要用于從放化療毒性中恢復(fù)患者,或糾正血液系統(tǒng)疾病(如遺傳性或獲得性障礙)。
值得注意的是:
- 90.6%的體外基因編輯HSCT試驗使用自體細胞,因其常用于修復(fù)患者自身HSC的遺傳缺陷。
- 87.5%的實體瘤治療HSCT試驗也采用自體細胞,這可能與20世紀早期異體HSCT的腫瘤靶向效果有限有關(guān),導致其使用率下降。
目前,HSCT在實體瘤治療中的主要目標是減輕放化療的毒性作用。
造血干細胞的組織來源
臨床中造血干細胞的三大來源為:
- 骨髓干細胞(髂骨穿刺采集);
- 動員外周血干細胞(通過粒細胞集落刺激因子G-CSF聯(lián)合白細胞分離術(shù)獲取);
- 臍帶血干細胞(分娩時采集)。
臨床偏好與挑戰(zhàn):
- 外周血干細胞因避免骨髓穿刺疼痛且移植后更快植活,成為成人首選,但其較高的適應(yīng)性免疫細胞含量可能增加GvHD風險。
- 骨髓干細胞雖在兒童中使用更普遍(因G-CSF在兒童中應(yīng)用受限且慢性GvHD風險更低),但在成人中占比已降至少數(shù)。
- 臍帶血干細胞因HSC產(chǎn)量低、重建速度慢,臨床應(yīng)用最有限,通常需多個單位聯(lián)合移植。
造血干細胞治療疾病適應(yīng)癥分布
HSCT的臨床試驗覆蓋廣泛疾病類型(圖5e),具體特點如下:
血液相關(guān)疾病(82.5%)
- 血液癌癥(53%):以異體HSCT為主(86.3%),探索新型預(yù)處理方案(如CRISPR-Cas9敲除CD33基因抵抗化療)。3.4%的試驗采用基因編輯HSCT(如抗HIV基因?qū)耄?/li>
- 遺傳性紅細胞疾病(33%):自體基因編輯HSCT占37%(如鐮刀型細胞病),通過單次干預(yù)實現(xiàn)終身治愈;其余多用異體HSCT以避免免疫并發(fā)癥。
- 免疫系統(tǒng)疾病(14%):80%采用自體HSCT(通過高劑量清髓實現(xiàn)免疫重置),20%嘗試異體HSCT聯(lián)合低強度預(yù)處理以建立混合嵌合體。
非血液相關(guān)疾病(17.5%)
- 實體腫瘤(37.5%):以自體HSCT為主(87.5%),目標為修復(fù)放化療損傷的骨髓/免疫系統(tǒng)。30%的腦癌試驗進入III期,探索HSCT歸巢腫瘤的機制(如靜脈注射后定向遷移)。
- 器官移植耐受(22%):92%為腎臟移植試驗,通過供體來源的HSCT重建受體免疫系統(tǒng),減少終身免疫抑制劑需求。
- 代謝性疾病(20.3%):75%采用自體基因編輯HSCT(如溶酶體儲存病),主要使用慢病毒載體,CRISPR技術(shù)或成主流。
間充質(zhì)干細胞(MSC)臨床試驗概況
在分析的346項臨床試驗中,MSC作為治療實體占比最大,但試驗階段分布呈現(xiàn)明顯早期主導特征:
- Ⅰ期(34.10%)、Ⅰ/Ⅱ期(27.46%)和Ⅱ期(21.10%)合計占82.66%,僅5.20%進入Ⅲ期(圖6a)。
- Ⅲ期試驗聚焦多領(lǐng)域:包括COVID-19(NCT05689008等)、骨關(guān)節(jié)炎(NCT05086939等)和心肌梗死(NCT01652209等)。此外,5項Ⅳ期試驗正在評估已上市產(chǎn)品(如Stempeucel?治療肢體缺血、Darvadstrocel治療肛周瘺)的長期效果。
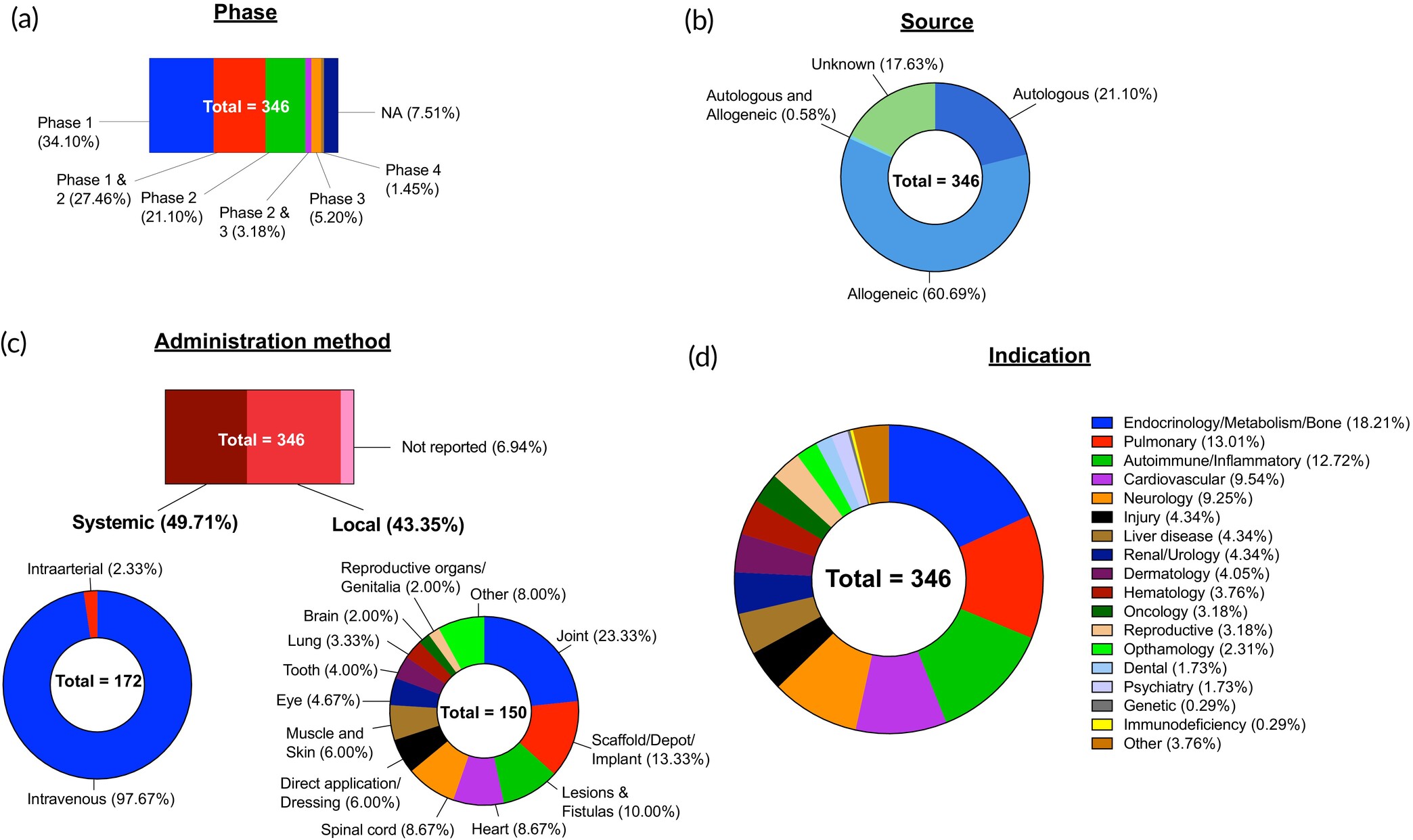
對346項MSC臨床試驗進行了分析,并根據(jù)以下標準進行了分類:(a) 試驗階段;(b) 細胞來源;(c) 給藥方法,進一步分為全身和局部途徑;(d) 適應(yīng)癥類型。不適用 (NA)。
間充質(zhì)干細胞來源
- 異體MSC占主導(60.96%),主要因其“免疫特權(quán)”假設(shè)(低免疫原性)和可即用性優(yōu)勢;但近年研究發(fā)現(xiàn)其可能引發(fā)免疫排斥,挑戰(zhàn)了這一傳統(tǒng)認知。
- 自體與異體對比試驗(如NCT05086939、NCT05789719)將為臨床選擇提供依據(jù)。
間充質(zhì)干細胞遞送方法
MSC遞送方式因疾病而異,局部與全身遞送各占約43%和49%:
1、全身遞送(靜脈/動脈注射):
- 常用于COVID-19、自身免疫病、神經(jīng)系統(tǒng)及肝病,以抗炎和免疫調(diào)節(jié)為主。
- 靜脈注射安全性高,但存在非特異性分布問題。
2、局部遞送:
- 關(guān)節(jié)內(nèi)注射(23.33%):針對骨關(guān)節(jié)炎,因軟骨低血管化需直接靶向。
- 鞘內(nèi)注射(8.67%):治療ALS、腦癱及脊髓損傷。
- 心肌內(nèi)/冠狀動脈注射(8.67%):修復(fù)心臟損傷,后者創(chuàng)傷更小但需專用設(shè)備。
- 肌肉注射(6%):通過緩釋作用延長細胞滯留,并通過分泌組產(chǎn)生系統(tǒng)性效應(yīng)。
3、生物材料技術(shù)(13.33%局部試驗):
- 如透明質(zhì)酸水凝膠(Cartistem?)聯(lián)合臍帶MSC修復(fù)軟骨、膠原支架(NeuroRegen?)促進脊髓損傷功能恢復(fù),顯著提升療效。
間充質(zhì)干細胞治療疾病適應(yīng)癥分布
MSC的免疫調(diào)節(jié)與再生特性推動其廣泛應(yīng)用于多領(lǐng)域(圖6d):
內(nèi)分泌/代謝/骨骼疾病(18.21%):
- 糖尿病:靜脈輸注MSC可調(diào)節(jié)炎癥因子,減少胰島素依賴(Ⅰ型)或降糖(Ⅱ型)。
- 骨關(guān)節(jié)炎:關(guān)節(jié)內(nèi)注射MSC促進軟骨再生,改善關(guān)節(jié)功能。
自身免疫/炎癥疾病(12.72%):
- COVID-19 ARDS:8項試驗顯示MSC通過抑制過度免疫反應(yīng)降低死亡率。
- GvHD:利用MSC免疫調(diào)節(jié)特性輔助HSCT治療。
心血管疾病(9.54%):
- 心肌梗死患者經(jīng)MSC治療可提高左心室射血分數(shù)。
呼吸系統(tǒng)疾病(13.01%):涵蓋COPD、肺纖維化等。
其他新興領(lǐng)域:
- 生殖功能障礙、干眼癥、遺傳性疾病(如亨廷頓病)等均開展探索。
關(guān)于間充質(zhì)干細胞的核心結(jié)論
- 階段分布特征:MSC臨床試驗高度集中于早期階段,成熟療法有限,需加速Ⅲ期驗證。
- 來源爭議:異體MSC雖占主流,但自體與異體的優(yōu)劣需通過頭對頭試驗明確。
- 遞送優(yōu)化:局部遞送結(jié)合生物材料技術(shù)可提升靶向性,全身遞送則需解決非特異性分布問題。
- 適應(yīng)癥擴展:從傳統(tǒng)血液/免疫疾病拓展至代謝、神經(jīng)退行性疾病及腫瘤輔助治療,展現(xiàn)廣泛應(yīng)用潛力。
- 基因編輯滯后:當前僅1項試驗探索基因工程MSC(TRAIL ligand修飾治療肺癌),技術(shù)成熟度不足。
未來需通過技術(shù)創(chuàng)新(如CRISPR編輯、智能遞送系統(tǒng))和大規(guī)模臨床驗證,推動MSC向精準治療轉(zhuǎn)化。
其他干細胞臨床試驗
在分析的臨床試驗中,113項(14.13%)涉及非HSC或MSC的其他干細胞類型,包括未純化的骨髓濃縮物、脂肪組織細胞、臍帶血,以及特定譜系的干細胞(如神經(jīng)干細胞、視網(wǎng)膜干細胞、角膜緣干細胞、心臟干細胞和誘導多能干細胞[iPSC]衍生細胞)(圖7)。
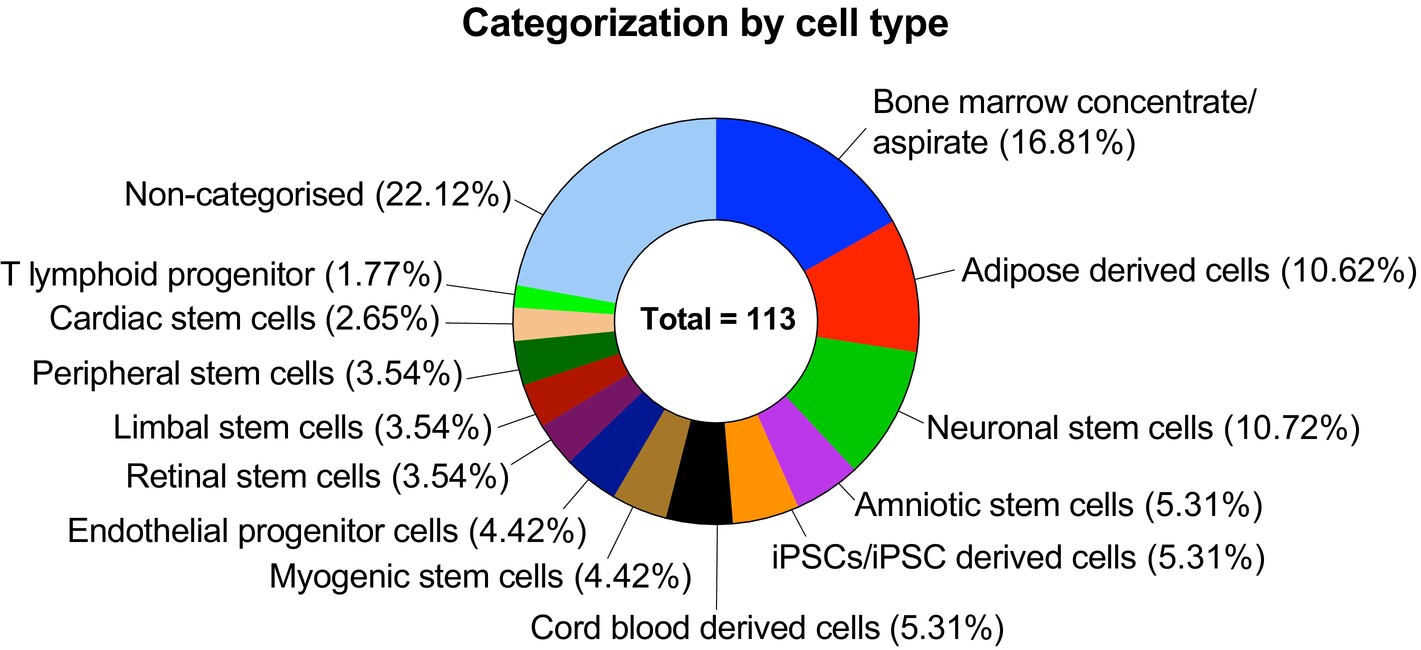
其中僅47項為特異性干細胞試驗,主要原因如下:
- 分化潛力與功能多樣性有限(相較于HSC和MSC);
- 來源與規(guī)模化制備難度較高(需達到治療劑量)。
主要研究方向與案例
眼科疾病(因易于操作、免疫特權(quán)環(huán)境和所需細胞量少成為重點):
- 角膜緣干細胞(4項):用于治療角膜緣干細胞缺乏癥(如NCT03957954);
- 視網(wǎng)膜干細胞(4項):探索黃斑變性治療(如NCT05187104)。
中樞神經(jīng)系統(tǒng)修復(fù)(12項):
- 神經(jīng)干細胞通過旁分泌和再生機制修復(fù)損傷(如NCT03684122)。
心臟疾病(3項):
- 心臟干細胞或iPSC衍生心肌細胞通過旁分泌和再生機制治療心臟病(如NCT03406884)。
- 內(nèi)皮祖細胞(5項):因強效的血管生成能力被用于心肌梗死(如NCT00936819)和肝硬化(如NCT03109236)治療。
其他領(lǐng)域:
- 局部遞送(約65%)為主流,例如心臟(冠狀動脈/心肌內(nèi)注射)和腦部(顱內(nèi)注射);
- 系統(tǒng)性遞送多用于未純化的粗提物(如骨髓濃縮物、脂肪組織)。
試驗階段與典型案例
多數(shù)試驗處于早期階段(Ⅰ/Ⅱ期),少數(shù)進入Ⅲ期(如NCT02781922:冠狀動脈注射心臟干細胞治療左心發(fā)育不全)。
創(chuàng)新案例:角膜緣干細胞通過局部移植修復(fù)角膜(NCT03957954);iPSC衍生細胞用于心肌再生(NCT03406884)。
干細胞治療臨床轉(zhuǎn)化的五大挑戰(zhàn)
盡管在臨床前和臨床領(lǐng)域都取得了重大進展,但在干細胞療法全面應(yīng)用于臨床之前,仍有幾個重大挑戰(zhàn)需要解決。一些關(guān)鍵考慮因素包括:
- 確定可行的干細胞來源,
- 解決安全性和免疫原性問題,
- 管理功能異質(zhì)性,
- 確保移植后的生物活性和活力,以及?
- 優(yōu)化靶向遞送和遷移能力(圖8)。
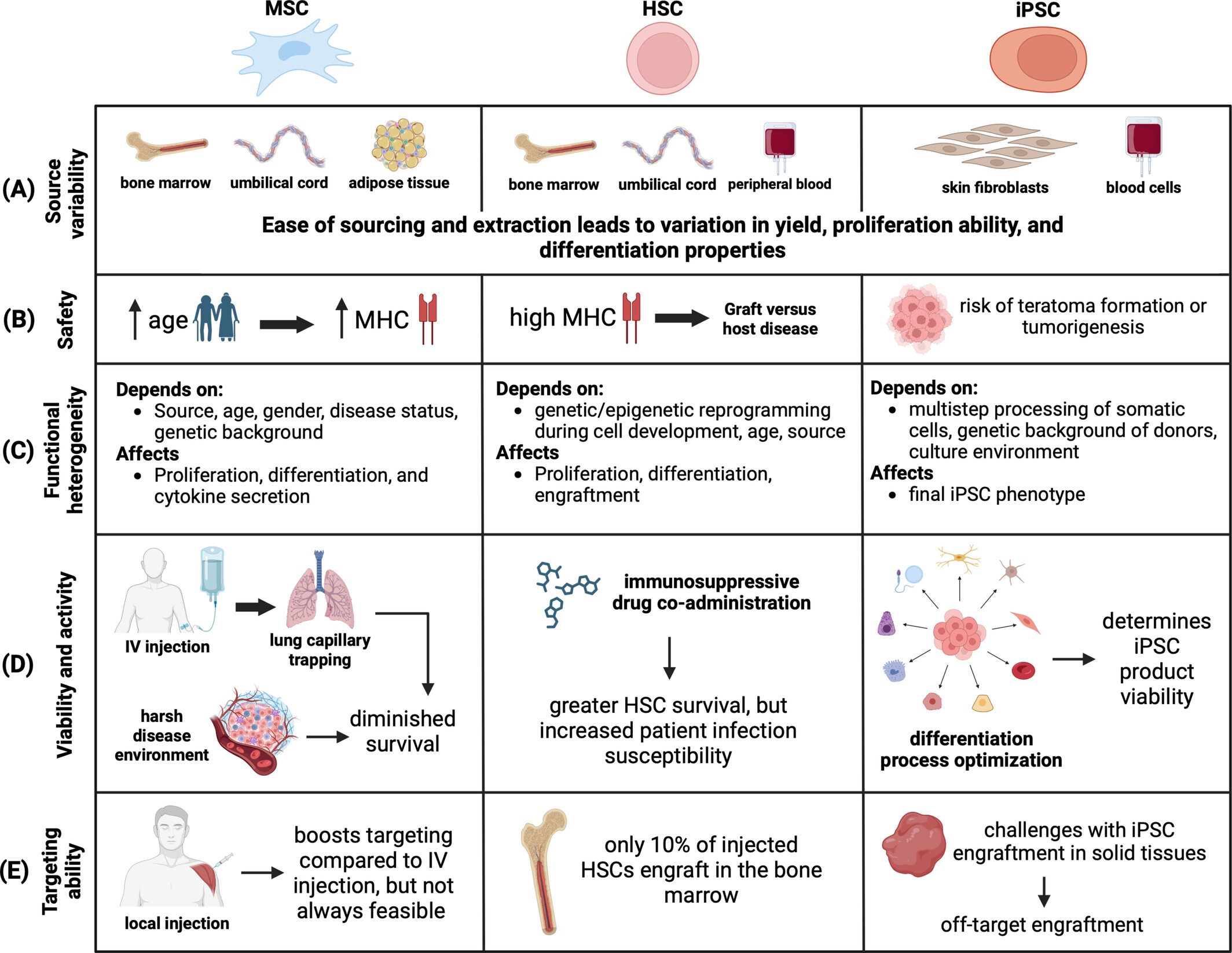
對于MSC、HSC和iPSC細胞類型,已識別并根據(jù)以下方面對各種挑戰(zhàn)進行了分類:(a) 來源多變性;(b) 安全性;(c) 功能異質(zhì)性;(d) 活力和活性;以及 (e) 靶向能力。
本節(jié)主要討論這些挑戰(zhàn),因為它們與廣泛使用的干細胞(如MSC和HSC)有關(guān),同時也研究了與iPSC相關(guān)的具體問題,iPSC正成為一種有前途的新型干細胞療法。
干細胞療法盡管挑戰(zhàn)存在,未來仍充滿希望
干細胞作為生命系統(tǒng)中具內(nèi)在自我更新與多向分化潛能的細胞群體,其治療價值已突破傳統(tǒng)醫(yī)學范式。全球范圍內(nèi),基于干細胞的創(chuàng)新療法已在血液系統(tǒng)疾病、遺傳缺陷修復(fù)及退行性疾病領(lǐng)域取得突破性進展,數(shù)十項產(chǎn)品獲得監(jiān)管機構(gòu)批準,臨床療效顯著。
隨著對干細胞功能機制的深入解析,研究者正著力拓展其應(yīng)用邊界至腫瘤免疫治療、器官再生及代謝疾病干預(yù)等新興領(lǐng)域,充分體現(xiàn)這一領(lǐng)域的多元化發(fā)展趨勢。
盡管前路荊棘,干細胞療法在臨床實踐中的持續(xù)突破——如CAR-T細胞治療血液腫瘤的革命性成功、iPSC衍生視網(wǎng)膜組織修復(fù)黃斑病變的突破性進展——已充分印證其作為下一代醫(yī)學核心工具的巨大潛力。隨著生物技術(shù)與工程技術(shù)的深度融合,這一領(lǐng)域有望在未來十年迎來爆發(fā)式增長,重塑人類疾病治療范式。
參考資料:Ekrani ST, Mahmoudi M, Haghmorad D, et al. Manipulated mesenchymal stem cell therapy in the treatment of Parkinson’s disease. Stem Cell Research & Therapy. 2024 Dec;15(1):476. DOI: 10.1186/s13287-024-04073-9. PMID: 39696636; PMCID: PMC11657756.
免責說明:本文僅用于傳播科普知識,分享行業(yè)觀點,不構(gòu)成任何臨床診斷建議!杭吉干細胞所發(fā)布的信息不能替代醫(yī)生或藥劑師的專業(yè)建議。如有版權(quán)等疑問,請隨時聯(lián)系我。



 掃碼添加官方微信
掃碼添加官方微信