2025年11月,全國多家知名醫院陸續啟動了10項干細胞治療相關臨床研究招募。
本文整理了這10項臨床招募的入選標準、聯系方式及參與方式,為患者提供最新的參考和資訊。
11月具體臨床招募患者包括:急性移植物抗宿主病、糖尿病腎病、早發性卵巢功能不全、原發性中樞神經系統淋巴瘤、兒童造血干細胞移植、局灶性硬皮病、宮腔粘連、難治性脊髓空洞癥、膝骨關節炎以及2型糖尿病患者。

01.干細胞治療急性移植物抗宿主病患者招募
11月5日,中國科學技術大學附屬第一醫院啟動了一項名為“使用DPPIV酶偶聯磷酸西格列汀片預防異基因外周血造血干細胞移植患者急性移植物抗血小板病發生的單中心II期臨床研究”的臨床招募。[1]
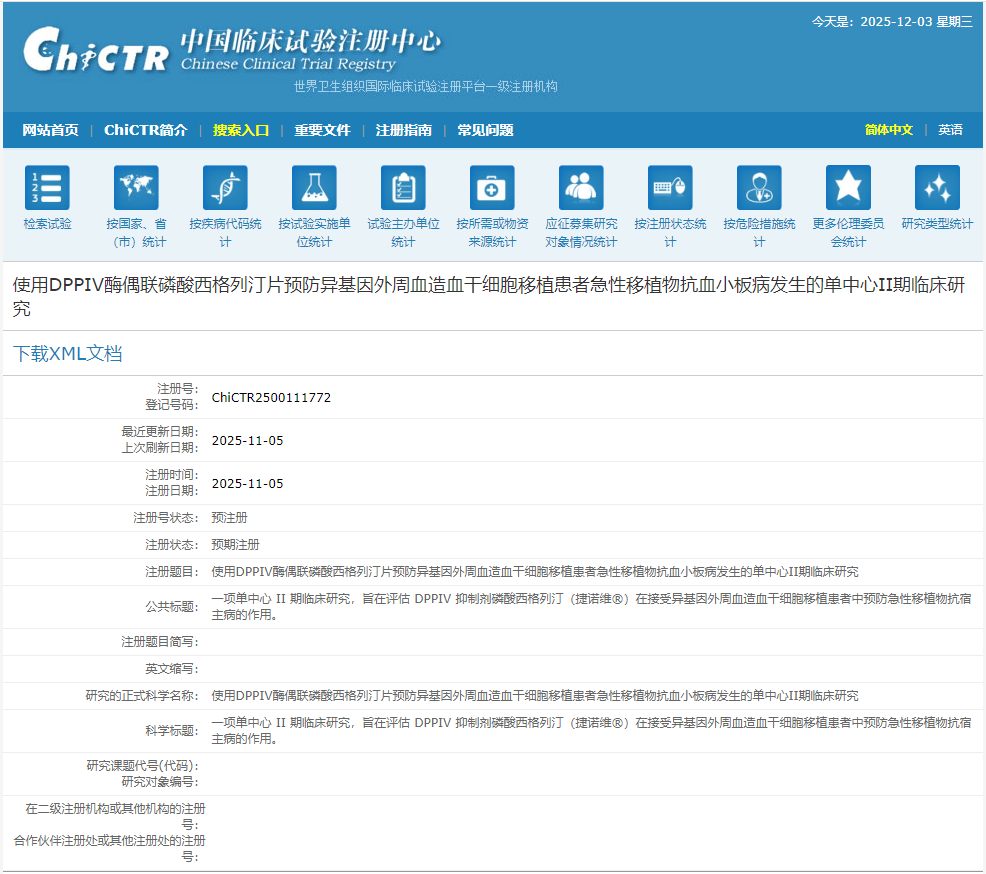
研究旨在評估DPPIV酶對磷酸西格列汀片(捷諾維?)改善單純異基因外周血造血干細胞移植(allo-PBSCT)患者急性移植物抗另外疾病(aGVHD)發生的安全性及有效性。
研究疾病:急性移植物抗宿主病(aGVHD)
納入標準為:
確診為血液系統疾病(如急性白血病、骨髓增生異常綜合征、再障、淋巴瘤),年齡18-65歲、計劃首次接受異基因外周血干細胞移植(allo-PBSCT,如MSDT、MUDT、HIDT),且ECOG評分0-2分、無嚴重器官功能損傷或活動性感染、愿意自愿參與研究并簽署知情同意書的患者。
排除標準包括:
心、肝、腎或肺功能嚴重受損;中樞神經系統疾病;有胰腺炎或膽結石史、嚴重糖尿病需用胰島素治療;妊娠或哺乳期;有藥物濫用、嚴重精神問題或認知障礙;對試驗藥物過敏;近期參加過類似研究;或研究者認為無法按要求配合治療和隨訪。
招聘時間:從2025年11月15日至2027年7月31日
聯系方式:
- 負責人電話:+86 152 5545 6091
- 負責人郵箱:xiaoyuz@ustc.edu.cn
- 負責人地址:合肥市廬江區廬江路17號
02.干細胞治療糖尿病腎病患者招募
11月6日,解放軍總醫院第一醫學中心腎臟病醫學部正在開展一項“評估艾米邁托賽注射液治療糖尿病腎病患者的有效性和安全性臨床研究” 。[2]
本研究使用的藥物為艾米邁托賽注射液,2025年1月2日國家藥監局(NMPA)通過優先審評審批程序附條件批準其上市。
本研究的主要目的是評估艾米邁托賽注射液治療臨床進展期糖尿病腎病患者的有效性,次要目的是評估艾米邁托賽注射液治療臨床進展期糖尿病腎病的機制及安全性。
入選標準:
年齡45-80歲,男女不限;確診Ⅱ型糖尿病并在過去10年內經腎活檢確診為糖尿病腎病;24小時尿蛋白≥3.5g且尿白蛋白/肌酐比值>1000 mg/g;eGFR≥20 ml/min/1.73m2;血壓≤160/100 mmHg;HbA1c<9%;患者或法定代理人簽署知情同意書。
聯系方式:
- 研究中心:解放軍總醫院第一醫學中心
- 項目負責人:李平 副主任醫師
- 咨詢地點:解放軍總醫院第一醫學中心門診大樓6層腎臟病醫學部(周一下午、周二上午)
- 項目聯系人:賀老師
- 咨詢電話:4009033180
03.干細胞治療早發性卵巢功能不全患者招募
11月7日,浙江大學醫學院附屬邵逸夫醫院生殖中心正在開展一項探索性的臨床研究,現面向社會最后招募20位早發性卵巢功能不全(POI)患者。[3]

本研究擬評價臍帶間充質干細胞卵巢原位注射治療POI的安全性和有效性,以期緩解病情、減輕癥狀,探索滿足患者生育愿望的可能性,提高患者的生活質量。
團隊前期基礎:團隊近期完成的2020年干細胞臨床研究顯示,臍帶間充質干細胞膠原復合支架移植可明顯改善薄型胚胎內膜的厚度、血管密度和營養表達,多例患者成功妊娠并妊娠且未出現不良反應,為進一步開展明顯不良反應。
現最終招募20名患者POI(基礎FSH 15–40 IU/L),入組后所有研究相關檢查和治療費用全免,包括術前檢查、細胞增殖及B超說明、腹腔鏡晚干細胞注射手術及麻醉費用,以及臍帶間充質干細胞和重組生長激素的使用。
入組標準:

排除標準:

招募時間:2021年12月1日至2026年1月31日
聯系方式:
- 186-0671-8838
- 159-5801-0234
04.干細胞治療原發性中樞神經系統淋巴瘤患者招募
11月7日,河南省人民醫院啟動了一項名為“塞替派聯合司莫司汀及阿糖胞苷預處理用于原發性中樞神經系統淋巴瘤自體造血干細胞移植的臨床研究”的臨床研究。[4]
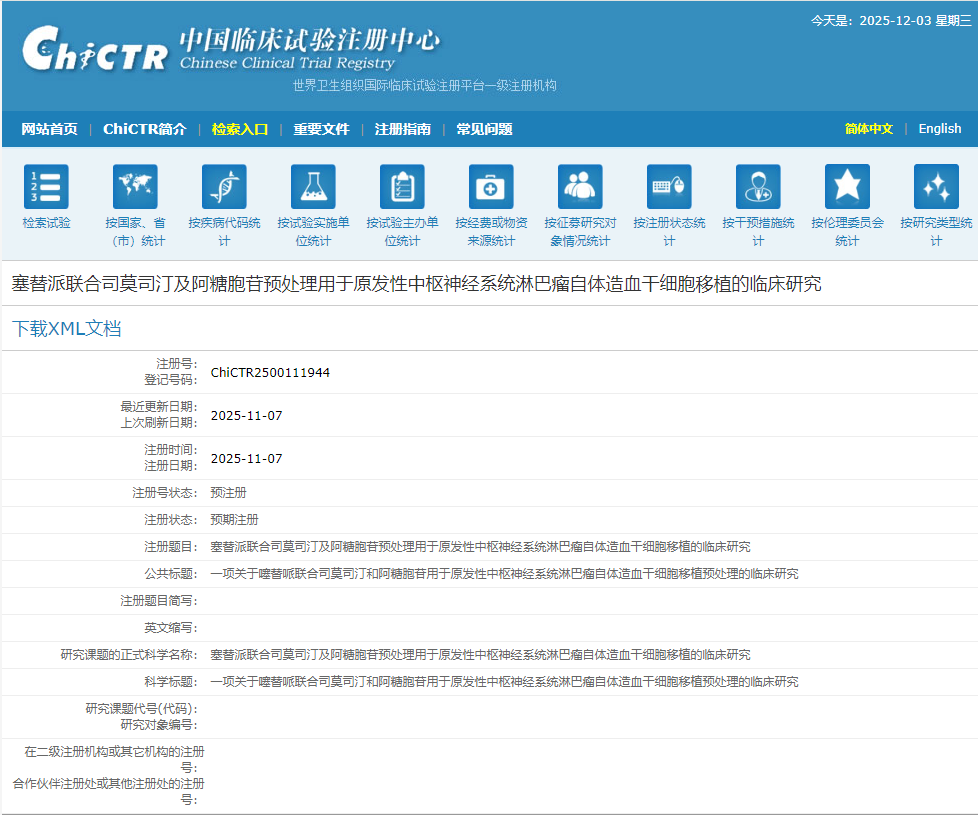
研究旨在探索塞替派聯合司莫司汀及阿糖胞苷預處理用于原發性中樞神經系統淋巴瘤(PCNSL)患者自體造血干細胞移植(ASCT)的療效與安全性。
研究疾病:原發性中樞神經系統淋巴瘤
干預措施:計劃接受自體造血干細胞移植的患者,接受塞替派+司莫司汀+阿糖胞苷的移植預處理方案治療。
納入標準為:
18-70歲的原發性中樞神經系統淋巴瘤患者,在誘導治療后病情達到部分緩解或更好(PR及以上),能夠接受自體造血干細胞移植(ASCT)。要求身體狀況良好(ECOG 0-2分),預計生存 ≥3個月,主要器官功能基本正常,采集到足夠數量的CD34+干細胞,并愿意參加研究并簽署知情同意書。
排除標準包括:
妊娠或哺乳期;曾接受過干細胞或骨髓移植;有影響造血功能的其他血液病;對研究藥物過敏;有嚴重心肺疾病或難以控制的感染;或研究者認為可能存在安全風險、無法完成治療和隨訪者。
招聘時間:從2025年11月7日至2028年10月1日
聯系方式:
- 負責人電話:+86 371 65896920
- 負責人郵箱:Yuanxiaoli@126.com
- 負責人地址:河南省鄭州市金水區緯五路7號
05.兒童造血干細胞移植招募
11月18日,蘇州大學附屬兒童醫院啟動了一項名為“兒童造血干細胞移植期間運動干預方案的構建與應用”的臨床研究。[5]
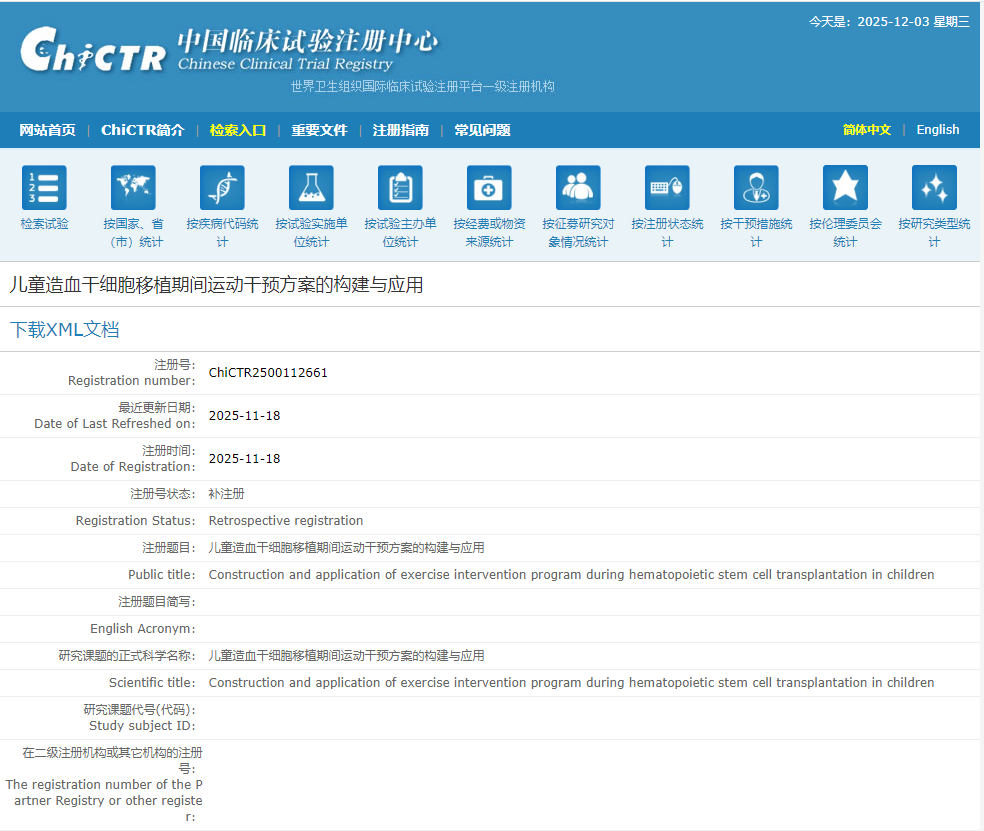
本研究旨在為接受造血干細胞移植的兒童制定并驗證一套可行的運動干預方案,通過隨機對照試驗觀察運動對患兒康復效果的影響,同時開發微信小程序用于推廣和指導實施該運動方案。
納入標準為:
年齡5至18歲、臨床醫生確認需要進行造血干細胞移植的兒童患者。
排除標準包括:
存在運動禁忌病癥(如嚴重神經系統疾病、肌肉骨骼損傷或嚴重心臟病)、患兒或照護者有明顯視聽言語障礙,或醫生認為運動可能加重病情者。
聯系方式:
負責人電話:+86 13073370828
負責人郵箱:wenfang11111@163.com
負責人地址:中國江蘇省蘇州市吳中區鐘南街92號
06.干細胞治療局灶性硬皮病頭面部及四肢皮膚硬化患者招募
11月19日,北京協和醫院啟動了一項名為“人脂肪間充質干細胞注射液局部注射用于局灶性硬皮病頭面部及四肢皮膚硬化的安全性、耐受性和初步有效性臨床研究”的臨床研究。[6]

本研究旨在初步評估脂肪間充質干細胞局部注射治療局灶性硬皮病(頭面部及四肢皮膚腫瘤)的有效性和安全性。
研究疾病:局灶性硬皮病頭面部及四肢皮膚硬化
納入標準為:
年齡18~60歲、診斷為斑塊狀、線型或泛發局灶性硬皮病且病灶位于頭面部或四肢、處于一個或淋巴期、能夠配合信號并有相關知情信息。
排除標準包括:
既往其他自身免疫病、嚴重器官或感染問題、腫瘤史、實驗室指標異常、已有干細胞或近期接受相關藥物/光療/激光/手術治療者;妊娠可能、藥物依賴、對制劑或麻醉藥物過敏、或者認為存在安全性。
聯系方式:
- 負責人電話:+86 138 1019 3175
- 負責人郵箱:pumclongxiao@126.com
- 負責人地址:王府井帥府園1號(100730)
07.干細胞治療宮腔粘連患者招募
11月20日,深圳市第三人民醫院啟動了一項”間充質干細胞外泌體治療宮腔粘連臨床試驗志愿者招募“的研究。[7]
如果您正因宮腔粘連導致月經量減少、不孕或反復流產,并渴望恢復子宮內膜功能、提高妊娠機會,可以報名參加這項臨床招募。計劃招募43名患者。
入組條件:①年齡為 18-45 歲;②有生育要求或改善月經異常的需求;③通過宮腔鏡或經陰道彩超診斷宮腔粘連。
(以上為部分入選指標標準,最終由研究醫生確定是否完全符合,并以相關檢查結果為準)
聯系方式:
- 地址:深圳市第三人民醫院F棟19樓婦科醫生辦公室
- 電話:(0755)61222333-71951(周一至周五 8:30-17:00)
- 聯系人:廖醫生
08.干細胞治療難治性脊髓空洞癥患者招募
11月21日,宣武醫院神經外科啟動了一項名為”評價人臍帶間充質干細胞外泌體注射液(hUC-MSCs-EV)治療難治性脊髓空洞癥(syringomyelia)患者的臨床安全性和有效性研究。“的臨床招募。[8]
本研究專門針對難治性脊髓空洞癥患者開展治療。
入組條件:年齡18-60歲,男女不限;確診脊髓空洞癥,經外科手術半年或長期保守治療后,MRI顯示空洞縮小但癥狀未改善;育齡期患者須在試驗期間及結束后6個月內采取有效避孕措施。
聯系方式:
- 菅鳳增主任醫師:神經外科周三夜間特需門診(17.00-20.00);
- 關健副主任醫師:神經外科周二上午專家門診;
- 袁醫生:17777784396(微信同號)
09.干細胞治療膝骨關節炎患者招募
11月28日,浙江大學醫學院附屬第二醫院啟動了“人臍帶間充質干細胞注射液治療膝骨關節炎的多中心、隨機、雙盲Ⅱ期臨床試驗”的啟動會。[9]
本研究旨在評估干細胞注射治療膝骨關節炎的安全性、有效性及最佳方案,為Ⅲ期臨床試驗及上市申請提供關鍵數據支撐。
本項目由國務院政府特殊津貼專家、國家“特支計劃”領軍人才陳海佳研究員與中國科學院蘇國輝院士牽頭,已在北京協和醫院、中山大學孫逸仙紀念醫院通過I期臨床試驗、國家衛健委備案的干細胞臨床研究驗證,獲得了良好的安全性和有效性臨床數據。
入組要求:
現公開招募40~75歲膝骨關節炎患者(性別不限),確診膝骨關節炎(符合中華醫學會骨關節炎診療指南標準)、X線顯示Kellgren-Lawrence分級Ⅱ~Ⅲ級、目標膝關節WOMAC疼痛評分20-42.5cm且總評分60-180cm、并自愿簽署知情同意書。
聯系方式:
- 符合條件的患者可報名咨詢:陸助理,電話17699664595;
- 地址:浙江省杭州市上城區解放路88號浙江大學醫學院附屬第二醫院。
10.干細胞治療2型糖尿病患者招募
11月30日,北京興德通醫藥科技股份有限公司(CRO)與北京吉源生物科技有限公司攜手,正式啟動一項針對2型糖尿病的I期臨床試驗。該試驗旨在評估人GLP-1和FGF21雙因子高表達脂肪干細胞注射液在2型糖尿病患者中的安全性、耐受性及初步有效性。[10]
該注射液由北京吉源生物研發,可同時促進胰島素分泌和增強葡萄糖利用,實現多機制協同降糖。此前在瑞金醫院和西京醫院的研究中,用藥安全性良好,并觀察到胰島素用量下降趨勢。
目前,該注冊性臨床試驗已在國內多家權威醫療中心同步開展,包括瑞金醫院、齊魯醫院和宣武醫院,現面向社會公開招募符合條件的受試者。
主要入選條件:
年齡18-65歲,性別不限;確診2型糖尿病,病程1-10年;既往使用GLP-1RA并聯合胰島素及其他降糖藥治療≥3個月,HbA1c 7.0%-12.0%;空腹血糖<12 mmol/L,空腹C肽≥0.8 ng/mL;BMI 24-40 kg/m2。
參與研究的獲益:
受試者將獲得專業內分泌專家團隊的全面評估和咨詢;研究期間所有用藥、訪視、實驗室檢查、住院及相關程序費用全免;根據實際情況,還將提供適當的交通、采血、脂肪采集及住院補貼。
聯系方式:
| 醫院 | 咨詢時間 | 聯系人 | 聯系電話 |
| 上海交通大學醫學院附屬瑞金醫院 | 周一至周五8:00-17:00 | 張老師 | 17633579375 |
| 山東大學齊魯醫院 | 周一至周五8:00-17:00 | 蔡老師 | 13156162762 |
| 首都醫科大學宣武醫院 | 周一至周五8:00-17:00 | 蔣老師 | 83198899轉9072 |
總結:總體來看,2025年11月啟動的這10項干細胞相關臨床研究,覆蓋了免疫并發癥、代謝性疾病、生殖醫學、神經系統疾病、骨關節退行性疾病等多個重點領域,既包括探索性研究,也包含Ⅱ期、注冊性臨床試驗,體現了我國干細胞治療正從安全性驗證逐步邁向療效評估和規范應用階段。對于符合條件的患者而言,參與正規臨床研究不僅有助于獲得前沿治療機會,也能在嚴格監管和隨訪體系下保障安全與權益。
如果您對上述臨床招募信息、入選條件或干細胞相關治療仍有不清楚之處,歡迎留言或關注杭吉泰迪干細胞微信公眾號私信,獲取進一步的科普解讀與參考信息。
參考資料:
[1]https://www.chictr.org.cn/showprojEN.html?proj=290270
[2]https://mp.weixin.qq.com/s/TZcMKAciaLXTrQE1gnN3ww
[3]https://mp.weixin.qq.com/s/8frUthlgAYOlJkwRzXl3Hg
[4]https://www.chictr.org.cn/showprojEN.html?proj=292763
[5]https://www.chictr.org.cn/showprojEN.html?proj=240761
[6]https://www.chictr.org.cn/showprojEN.html?proj=296695
[7]https://mp.weixin.qq.com/s/t9n0geN47r9mrX11pAOheg
[8]https://mp.weixin.qq.com/s/2D20ehGX0KwbM35NPz3WeA
[9]https://mp.weixin.qq.com/s/UPaJwEPc9fwlCccrkHeoew
[10]https://mp.weixin.qq.com/s/BHevcVMxQNOAzxhAKHXM-g
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。




 掃碼添加官方微信
掃碼添加官方微信