腦癱(Cerebral Palsy, CP)是兒童期最常見的運動障礙性疾病,全球約每300名新生兒中就有1例受此困擾。盡管康復訓練和藥物治療可改善部分癥狀,但其核心病因——胎兒或嬰幼兒期的腦損傷導致的神經(jīng)元不可逆損傷——仍無法根治。
這一困境催生了干細胞治療的探索:通過移植具有再生潛能的干細胞,修復受損神經(jīng)回路,為患者帶來“重塑大腦功能”的希望。然而,干細胞來源(自體或異體)、類型(骨髓、臍帶血、間充質干細胞等)及給藥途徑等因素均可能影響治療安全性。
本文基于多項臨床研究與安全性數(shù)據(jù),系統(tǒng)分析不同干細胞類型與來源在腦癱治療中的安全性,并結合患者需求為臨床決策提供科學依據(jù)。
自體vs異體:不同來源的干細胞治療腦癱患者的安全性有區(qū)別嗎?
一、自體干細胞:免疫排斥風險低,但來源受限
自體干細胞來源于患者自身(如骨髓、外周血或脂肪組織),因免疫原性低,無需免疫抑制,安全性較高。
1.1 臍帶血干細胞
安全性優(yōu)勢:自體臍帶血干細胞因免疫原性低,罕見急性排斥反應。例如,2018年廣東省婦幼保健院對12例腦癱患兒進行自體臍血輸注后,未報告嚴重不良反應,僅在少數(shù)病例中出現(xiàn)短暫低熱。

局限性:需提前儲存臍帶血,且細胞數(shù)量與活性受儲存時間影響。西安交通大學的研究顯示,自體臍帶血治療組患兒癥狀改善顯著,但需多次輸注維持療效。
1.2 骨髓來源干細胞
安全性:多項臨床試驗顯示,自體骨髓間充質干細胞(BM-MSCs)或單核細胞(BM-MNCs)通過蛛網(wǎng)膜下腔或脊髓內(nèi)注射后,未報告嚴重不良反應。例如:
- Himanshu等(2016)對10例腦癱患者的臨床試驗中,自體BM-MSCs治療24個月內(nèi)未出現(xiàn)免疫排斥或感染。
- Xuebin Liu等(2017)的隨機對照試驗進一步證實,BM-MSCs比BM-MNCs安全性更優(yōu)。
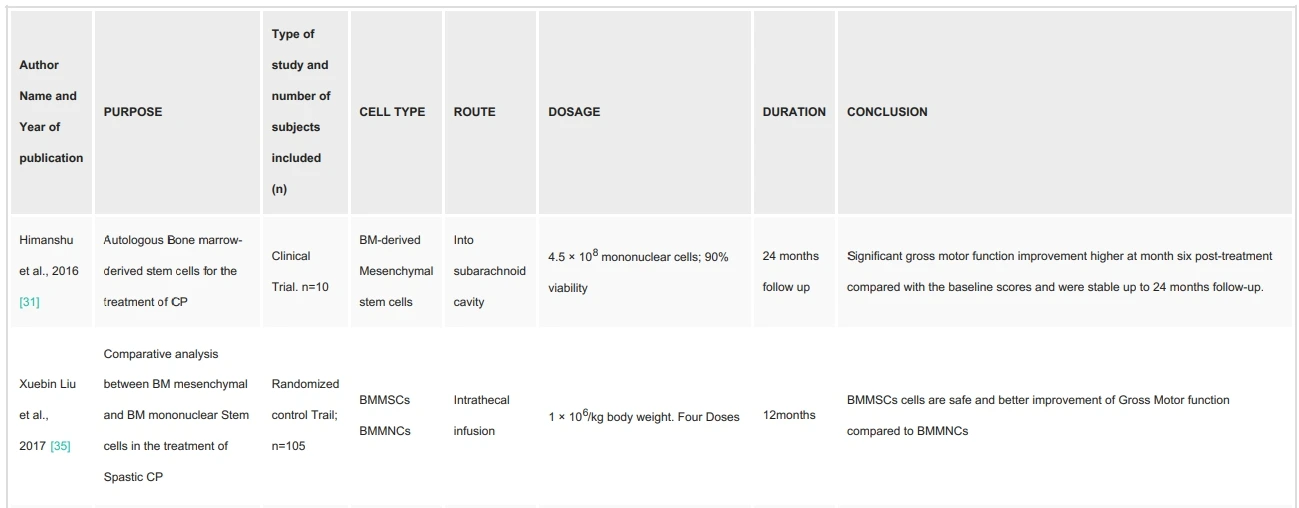
局限性:骨髓采集需侵入性操作,可能引發(fā)局部疼痛或感染風險。
1.3 脂肪來源間充質干細胞(AD-MSCs)
安全性:2022年3月1日,贛南醫(yī)學院干細胞臨床轉化工程技術研究中心牽頭在國際期刊《美國轉化醫(yī)學雜志》上發(fā)表了一篇關于“脂肪間充質干細胞移植治療腦癱五例療效觀察:病例報告”的研究成果。研究表明,靜脈注射ADMSCs后,沒有觀察到明顯的安全性問題。
局限性:主要在于其功能異質性受供體年齡和疾病狀態(tài)影響(如老年供體細胞活性下降40%)。
二、異體干細胞:免疫風險可控,需關注細胞類型與來源
異體干細胞(如臍帶間充質干細胞、胚胎神經(jīng)干細胞)來源廣泛,但需警惕免疫排斥和倫理爭議。
2.1 臍帶間充質干細胞(UC-MSCs)
安全性:臍帶間充質干細胞(UC-MSCs)因低表達MHC-II類分子,具有極低的免疫原性,顯著降低了同種異體移植的免疫排斥風險。我國科研團隊于2020年在《Stem Cell Research and Therapy》發(fā)表的隨機對照試驗表明,UC-MSCs治療腦癱患兒的安全性良好:不良事件(AE)以輕度或中度的上呼吸道感染、腹瀉和發(fā)熱為主,且各治療組發(fā)生率無顯著差異,未觀察到嚴重不良事件(SAE)。(見圖1)
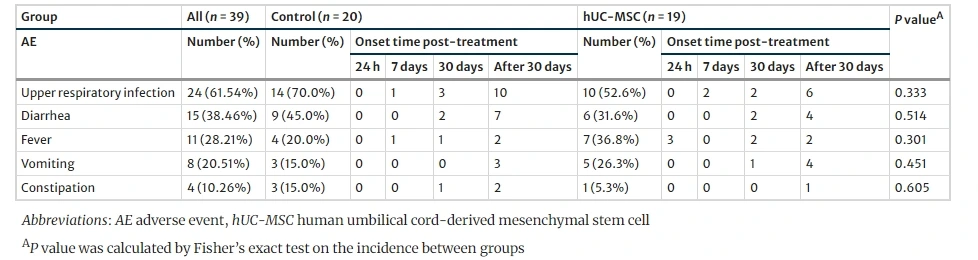
潛在風險:長期使用可能引發(fā)抗體產(chǎn)生,需監(jiān)測遠期免疫反應。
2.2 胚胎神經(jīng)干細胞(NSCs)
安全性:2023年行業(yè)期刊《干細胞研究與治療》上發(fā)表了一項隨機1/2期對照試驗。驗證了腦癱患者鼻腔內(nèi)注射神經(jīng)干細胞的長期安全性和有效性。25例腦癱患者在移植后24個月內(nèi)未發(fā)生與鼻腔給藥治療或NSCs相關的嚴重AE。觀察到的AE大多為I級和II級或為一過性事件,治療組僅有4例輕微不良反應,持續(xù)時間在移植后數(shù)小時至3天不等。(見圖2)
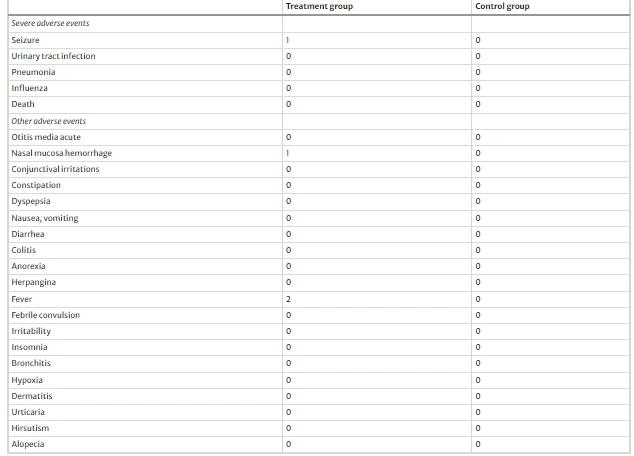
倫理爭議:胚胎來源涉及倫理問題,且需嚴格篩選供體以避免病原體傳播。
三、影響安全性的關鍵因素
給藥途徑的影響
- 靜脈注射:全身性擴散可能引發(fā)肺栓塞或器官滯留,但UCB相關研究未觀察到此類風險。
- 局部注射(脊髓或腦內(nèi)) :侵入性操作可能導致神經(jīng)損傷或感染,需嚴格無菌條件。
劑量與制備標準化:細胞劑量過高可能引發(fā)異常增殖或免疫激活。例如,2020年加州研究所發(fā)表的臨床結果表明BM-MNCs單次劑量超過200 mL時,部分患者出現(xiàn)短暫發(fā)熱。
結語
自體干細胞以零免疫排斥的安全性成為基礎選擇,而異體干細胞通過優(yōu)化配型與給藥方式,可平衡療效與風險。未來需通過標準化操作、個體化方案與長期隨訪,將干細胞治療的安全性與有效性最大化。臨床實踐中,應以患兒需求為中心,結合機構資質與循證數(shù)據(jù)謹慎決策,避免盲目追求“一蹴而就”的療效,而是通過科學、漸進的治療路徑為腦癱患兒帶來真實而持久的改善。
相關閱讀:干細胞治療腦癱:臍帶血、間充質干細胞與神經(jīng)干細胞哪個更安全?
參考資料:
Vankeshwaram V, Maheshwary A, Mohite D, et al. (September 02, 2020) Is Stem Cell Therapy the New Savior for Cerebral Palsy Patients? A Review. Cureus 12(9): e10214. DOI 10.7759/cureus.10214
Hu, K., Wang, R. ., Xiao, B. ., Xiao, B. ., Gu, Y. ., Liu, F. ., … Wen, Y. . (2022). Effect of adipose-derived mesenchymal stem cell transplantation in five patients with cerebral palsy: A case report. American Journal of Translational Medicine, 6(1), 33–40. Retrieved from https://journals.publicknowledgeproject.org/default3/index.php/ajtm/article/view/2253
Gu, J., Huang, L., Zhang, C. et al. Therapeutic evidence of umbilical cord-derived mesenchymal stem cell transplantation for cerebral palsy: a randomized, controlled trial. Stem Cell Res Ther 11, 43 (2020). https://doi.org/10.1186/s13287-019-1545-x
Lv, Z., Li, Y., Wang, Y. et al. Safety and efficacy outcomes after intranasal administration of neural stem cells in cerebral palsy: a randomized phase 1/2 controlled trial. Stem Cell Res Ther 14, 23 (2023). https://doi.org/10.1186/s13287-022-03234-y
免責說明:本文僅用于傳播科普知識,分享行業(yè)觀點,不構成任何臨床診斷建議!杭吉干細胞所發(fā)布的信息不能替代醫(yī)生或藥劑師的專業(yè)建議。如有版權等疑問,請隨時聯(lián)系我。



 掃碼添加官方微信
掃碼添加官方微信