阿爾茨海默病 (AD) 是最常見的老年癡呆類型,2019年導致超過121,499人死于AD,使AD成為美國的第六大病因。AD是一種進行性神經退行性疾病,其特征是記憶力下降,行為障礙會影響一個人獨立運作的能力,最終導致死亡。
近年來各類干細胞治療阿爾茨海默病的臨床試驗

盡管對AD的病理生理學的理解取得了進展,但該疾病的治療選擇是有限的。近年來,利用干細胞進行臨床前研究和臨床試驗的突破為研究和治療AD患者的新視角鋪平了道路。干細胞在生物體的整個生命周期中具有自我更新、增殖、分化和產生分化細胞的獨特能力。由于這些特性,這些細胞被認為是細胞替代療法的最合適選擇。
迄今為止,已經描述了幾種具有不同差異能力的干細胞來源。全能細胞起源于一兩次合子分裂后的卵裂球,具有產生所有組織的能力,最終形成整個生物體,包括額外的胚胎組織。多能干細胞可以產生所有三個胚層,即內胚層、外胚層和中胚層。胚胎干細胞 (ESCs),源自內細胞團 (ICM) ,以及誘導多能干細胞 (iPSCs),可通過體細胞的核重編程在體外產生 (圖1),是多能干細胞的顯著例子。
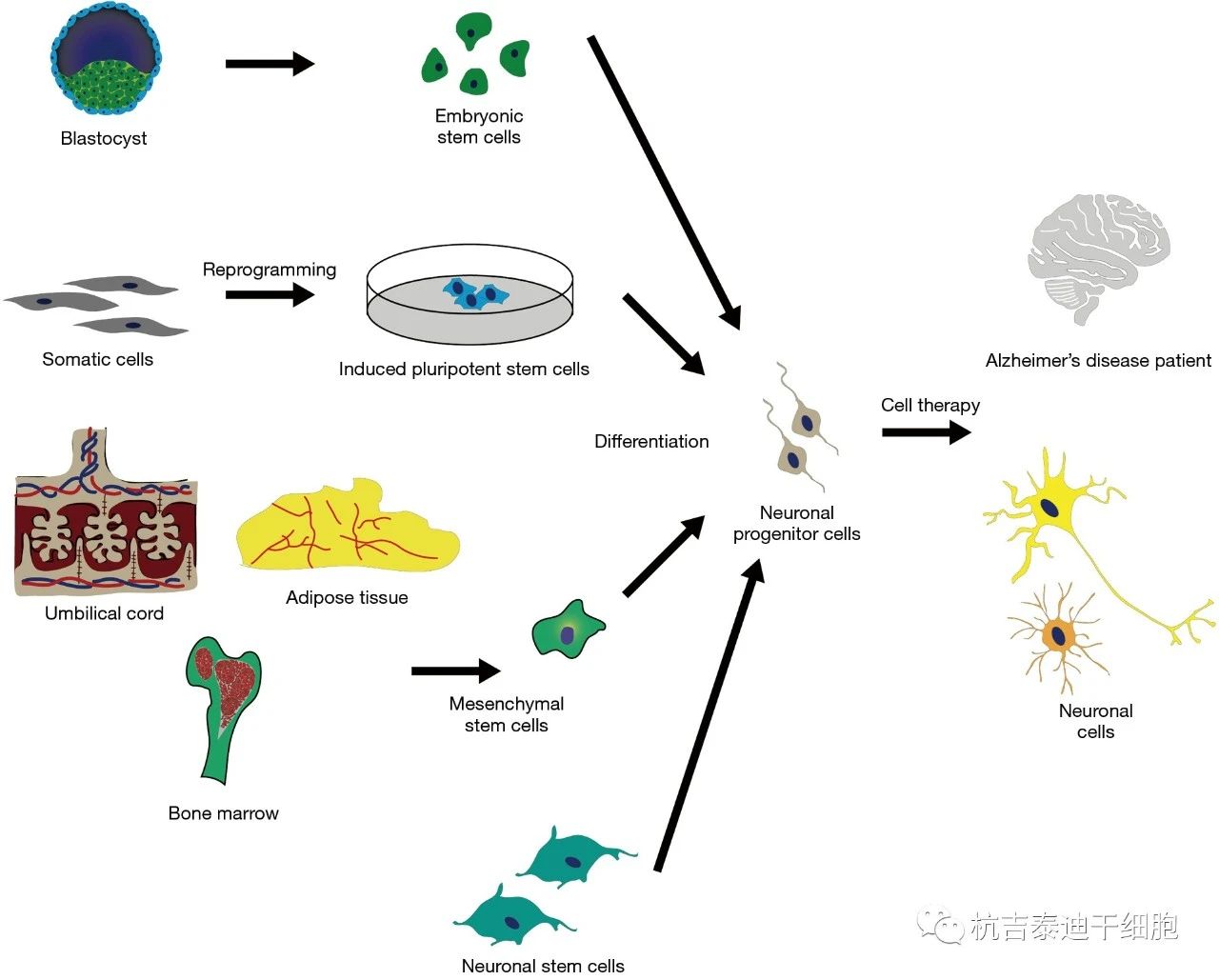
近年來各類干細胞治療阿爾茨海默病的臨床試驗
在當前的文章中,我們回顧了關于不同來源的干細胞治療阿爾茨海默病的最新進展,并在國家和國際登記處提供了每個可用臨床試驗的綜合列表。最后,我們討論了由AD病理學和技術限制引起的阻礙干細胞技術從實驗室向床邊轉變的缺陷。我們的研究結果強調需要增加臨床試驗,以揭示移植細胞的作用方式和潛在的治療機制,以及控制再生和神經元微環境的分子機制。
胚胎干細胞與神經干細胞治療阿爾茨海默癥的臨床試驗
ESC在體外具有無限增殖壽命,同時還具有在體內產生任何成體細胞的能力。限制胚胎干細胞在臨床試驗中使用的障礙包括它們的純化和保存過程、分離細胞的多能性驗證、胚胎體形成、它們的致瘤能力以及使用人類胚胎干細胞 (hESCs) 產生的倫理影響源于植入前胚胎。然而,它們作為AD嚙齒動物模型中細胞移植來源的作用已被廣泛研究。
胚胎神經干細胞也被研究作為AD小鼠模型中治療細胞的另一種可能來源。神經干細胞是多能神經前體,可在體外和體內分化成神經元、星形膠質細胞和少突膠質細胞。已經提出了解釋神經干細胞可能的疾病改善作用的不同機制,包括神經血管損傷修復、通過與小膠質細胞相互作用的免疫調節、神經元替代、神經遞質補充、促進突觸可塑性和細胞存活的神經營養支持。神經干細胞可以分化并產生成熟的神經元(直接神經發生)或首先分化成神經NPC(間接神經發生)。將胚胎小鼠神經干細胞移植到APP/PS1小鼠海馬中后,可誘導增強突觸修復和保護基底前腦中的膽堿能神經元。
測試這些類型干細胞的臨床試驗僅記錄在中國臨床試驗注冊中心(表格1)。
表格1:神經干細胞治療阿爾茨海默病癥患者的臨床試驗
| 干涉 | 劑量[n]/途徑 | 臨床階段/標識符 | 數量/條件 | 地位 | 主要發現 | 參考號 |
|---|---|---|---|---|---|---|
| 人神經干細胞 | (I)低劑量[10]/鼻內; (II)中等劑量[10]/鼻內;(III)高劑量[10]/鼻內; (IV) 安慰劑[10]/鼻內 | NA/ChiCTR2000028744 | 40/AD診斷;50-75歲;MMSE 10–20;Hachinski缺血評分改善≤4分;漢密爾頓精神抑郁量表≤10;Fazekas 量表 ≤2 | 尚未招募 | 不適用 | ( 61 ) |
| 人神經干細胞 | (I) 低劑量[9]/鼻內; (II)中等劑量[9]/鼻內; (III)高劑量[9]/鼻內; (IV) 安慰劑——生理鹽水[9]/鼻內 | NA/ChiCTR2000039011 | 36/可能公元;50-75歲;MMSE 5-20;Hachinski缺血評分≤4;GDS≤10;Fazekas量表≤2;MTA分數≥2 | 尚未招募 | 不適用 | ( 62 ) |
| 自體 hNSC | 不適用 | NA/ChiCTR-ONC-17014171 | 30/AD診斷;40-80歲;無血液、肝臟、腎臟或胸部病變 | 未經倫理委員會批準 | 不適用 | ( 63 ) |
間充質干細胞和造血干細胞治療阿爾茨海默病的臨床試驗
在不同的成體干細胞系中,間充質干細胞和造血干細胞很容易獲得,因此已成為最廣泛研究的可能的AD療法。間充質干細胞是分級的出生后干細胞,能夠自我更新并保持多種分化潛能。間充質干細胞可以從多種來源中分離出來,可以分化成多種類型的組織,具有高擴增能力和低免疫原性和致癌潛力。
- 關于它們在AD病理學中的作用,據報道,間充質干細胞通過釋放神經營養因子來增強神經發生,增強Aβ清除,通過上調IL-10等神經保護細胞因子來改變先天性和適應性免疫細胞反應,同時減少促炎細胞因子的量TNF-α和IL-1β。還觀察到β-淀粉樣蛋白沉積減少和小膠質細胞吞噬活性增加。
已經有多項臨床研究檢查了hUC-MSCs在AD患者中可能的治療益處。表2)。
表2:臍帶、羊膜和胎盤間充質干細胞治療阿爾茨海默病患者的臨床試驗
| 干涉 | 劑量[n]/途徑 | 臨床階段/標識符 | 數量/條件 | 地位 | 主要發現 | 參考號 |
|---|---|---|---|---|---|---|
| 人臍帶間充質干細胞 | (一)低劑量:3×106個細胞/腦[3]/IC;(二)高劑量:6×106 個細胞/腦[6]/IC | I期/NCT01297218和I、IIa 期/NCT01696591 | 9/可能AD;>50歲;K-MMSE 10–24;正向PIB-PET | 完全的 | 無嚴重不良事件;無劑量限制性毒性。K-MMSE變化:低劑量-9.5±0.7;高劑量-8.4±5.6。ADAS-Cog變化:低劑量20.0±9.9;高劑量8.6±13.1 | ( 79 – 81 ) |
| 人臍帶間充質干細胞 | 第1階段:(I)低劑量:1×107個細胞/腦[3]/ICV,3次輸注;(II)高劑量:3×107個細胞/腦[6]/ICV,3次輸注。第2階段:(I)高劑量:3×107個細胞/腦[24]/ICV,3次輸注;(II)安慰劑(生理鹽水2mL)[12]/ICV,3次輸注 | I期、IIa期/ NCT02054208 | 46/可能公元;50-85歲;K-MMSE 18-26;陽性 PIB-PET 或 florbetaben PET | 完全的 | 第一階段結果:輸注后出現短暫發熱和腦脊液白細胞增多(9 名患者)。CSF 生物標志物:注射后 1 天,t-tau、p-tau、Aβ42 減少,MSC 標志物增加。K-MMSE變化(12周):低劑量0.0±2.0;高劑量0.7±1.6。ADAS-Cog變化(12周):低劑量0.7±4.0;高劑量2.3±5.0 | ( 82 , 83 ) |
| 人臍帶間充質干細胞 | 不適用 | I期、IIa期/ NCT03172117 | NCT02054208的主題 | 招聘 | 不適用 | ( 84 ) |
| 人臍帶間充質干細胞 | 不適用 | 不適用/ NCT04954534 | 在NCT02054208中接受安慰劑治療的受試者 | 尚未招募 | 不適用 | ( 85 ) |
| 人臍帶間充質干細胞 | 0.5×106個細胞/kg [30]/IV,8次輸注 | 一、二期/ NCT01547689 | 30/可能AD;50-85歲;最小均方誤差 3–20 | 未知 | 不適用 | ( 86 ) |
| 人臍帶間充質干細胞 | (I)0.5×106個細胞/kg/IV,8次輸注; (II)安慰劑(生理鹽水)/IV,8次輸注 | 一、二期/ NCT02672306 | 16/可能患有 AD 或混合性癡呆;50-85歲;最小均方誤差 10-26;膽堿酯酶抑制劑或重酒石酸卡巴林膠囊治療 | 未知 | 不適用 | ( 87 ) |
| 人臍帶間充質干細胞 | 1×107細胞 [6]/IV,4次輸注 | 一期/ NCT04040348 | 6/AD 或可能 AD;50-85歲;MMSE 20-26;淀粉樣蛋白 PET 或 CSF Aβ42 陽性 | 招聘 | 不適用 | ( 88 ) |
| 人羊膜和 UC-MSC | 靜脈注射、鼻內、霧化器取決于患者情況 | 一期/ NCT03899298 | 5,000/多種健康狀況;>18歲 | 尚未招募 | 不適用 | ( 89 ) |
| 人羊膜和 UC-MSC | 路線取決于患者狀況 | 一期、二期/ NCT04684602 | 5,000/多種健康狀況;>18歲 | 招聘 | 不適用 | ( 90 ) |
| 人胎盤 MSC (CB-AC-02) | 第1階段:(I)第1組:2×108個細胞/IV,1次注射;(II)第2組:2×108個細胞/IV,注射2次。第2階段:(I)第1組(K-MMSE20-26):2×108 個細胞/IV,2次注射;(II) 第2組 (K-MMSE10–19):2×108個細胞/IV,注射2次;(III) 安慰劑[12]/ICV,2次注射 | 一、二期/ NCT02899091 | 24/可能公元;>50歲;最小均方誤差 10-26;淀粉樣蛋白 PET 陽性;MRI 或 PET 結果提示 AD | 招聘 | 不適用 | ( 91 ) |
胎盤干細胞治療阿爾茨海默病的臨床試驗
據報道,胎盤是MSCs的另一個有效來源。CB-AC-02(人胎盤 MSCs)靜脈移植的安全性和潛在治療效果將在I/IIa期臨床試驗(NCT02899091)中進行評估,該試驗目前正在招募參與者。這項隨機試驗將招募24名可能患有AD、淀粉樣蛋白配體正電子發射斷層掃描 (PET) 呈陽性淀粉樣蛋白以及MRI或PET掃描影像學發現的患者。
脂肪干細胞在治療阿爾茨海默病的臨床試驗
脂肪衍生的SCs (ADSCs) 已被廣泛研究,因為脂肪組織取材方便。
臨床前證據已轉化為幾項正在進行的臨床試驗(表3)。
表3:脂肪間充質干細胞治療阿爾茨海默病患者的臨床試驗
| 干涉 | 劑量[n]/途徑 | 臨床階段 | 數量/條件 | 地位 | 主要發現 | 參考號 |
|---|---|---|---|---|---|---|
| ADSVF | 3.5–20cm3SVF,每次注射4.05×105–6.2×107個細胞/cm3/ICV,AD患者輸注1–8次 | 第一階段 | 31/多種神經系統疾病,公元 10年 | 完全的 | 輕微副作用(頭痛、切口痛);8例患者病情穩定或好轉;3名患者的腦脊液生物標志物減少 | ( 96 ) |
| ADSVF | 路線取決于患者狀況 | 不適用/ NCT01953523 | 3,000/多種健康狀況;>16歲 | 完全的 | 不適用 | ( 97 ) |
| 自體ADSC (AstroStem) | (I) 自體ADSC[11]/IV,注射9次; (II) 安慰劑(含30%自體血清的生理鹽水)[10]/IV,注射9次 | 一期、二期/NCT03117738 | 21/可能公元;>50歲;最小均方誤差 16–26 | 完全的 | 沒有不良事件報告;ADAS-Cog變化:Astrostem +5.9±6.8安慰劑 +3.0±5.4;MMSE 變化:Astrostem -3.4±2.8安慰劑 -1.4±2.8 | ( 98 ) |
| 自體ADSC (AstroStem) | (I) 2個注射器,裝有2.0×108個細胞/20mL鹽水和30%自體血清和多奈哌齊安慰劑/IV,注射4次;(II) 5mg多奈哌齊和 Astrostem安慰劑/IV,4 次注射 | IIb期/NCT04482413 | 80/可能輕度 AD;>50歲;MMSE20-24;自診斷以來未服用AD藥物;ADCSF生物標志物陽性 | 尚未招募 | 不適用 | ( 99 ) |
| ADSC (HB-adMSC) | 2.0×108個細胞/IV,注射4次 | I期、IIa期/NCT04228666 | 不適用 | 因新冠肺炎而撤回 | 不適用 | ( 100 ) |
| 自體微血管干/基質細胞 | 靜脈注射路線 | 不適用/ NCT03297177 | 300/多種神經系統疾病;18-90歲;診斷后6個月;目前的藥物治療失敗 | 尚未招募 | 不適用 | ( 101 ) |
| 自體ADSC | 2.0×108個細胞/IV,注射4次 | NA/JPRN-jRCTb030190214 | 32/可能有輕度至中度AD;65-85歲;MMSE提示AD | 暫停 | 不適用 | ( 102 ) |
| 脂肪干細胞 | 不適用 | 不適用/ NCT04855955 | AD晚期,伴有嚴重認知障礙;目前的藥物治療失敗 | 可用的 | 不適用 | ( 103 ) |
| 間充質干細胞外泌體 | (一)低劑量:5μg/鼻滴,每周2次,持續12周;(II)中劑量:10μg/鼻滴,每周2次,持續12周;(III)高劑量:20μg/鼻滴,每周2次,持續12周 | I、II期/ NCT04388982和ChiCTR2000032579 | 9/輕度或中度AD;>50歲;MMSE10-24;改良Hachinski 缺血評分<4;暫停服用認知增強藥物 | 招聘 | 不適用 | ( 104 , 105 ) |
骨髓間充質干細胞和造血干細胞治療阿爾茨海默病患者的臨床試驗
這些令人鼓舞的臨床前結果導致了許多臨床試驗的發展(表4)。
| 干涉 | 劑量[n]/途徑 | 臨床階段 | 數量/條件 | 地位 | 主要發現 | 參考號 |
|---|---|---|---|---|---|---|
| Longeveron 同種異體 hMSC | (一)低劑量:2×107個細胞[10]/IV,注射1次;(II)高劑量:1×108個細胞[10]/IV,注射1次;(III) 安慰劑(Plasmalyte A 和1%人血清白蛋白)[5]/IV,1次注射 | 一期/ NCT02600130 | 33/AD診斷;50-80歲;MMSE 18-24;MRI、淀粉樣蛋白 PET 結果呈陽性 | 主動,不招聘 | 不適用 | ( 117 ) |
| 同種異體 hMSC | (I) hMSC 和乳酸林格氏液/IV,注射 1 次;(II) 安慰劑(乳酸林格氏液)/IV,1 次注射 | IIa期/ NCT02833792 | 40/輕度至中度AD;55-80歲;MMSE 12-24;淀粉樣蛋白陽性的氟倍吡酯 PET | 招聘 | 不適用 | ( 118 ) |
| 骨髓間充質干細胞 | (I) 第 1 組:14 cc/IV,1 次注射;(II) 第 2 臂:14 cc 和近紅外光/IV,1 次注射;(III) 第 3 組:14 cc 和 1 cc 鼻內/IV,1 次注射 | 不適用/ NCT03724136 | 100/AD 或自閉癥譜系障礙;>18歲 | 招聘 | 不適用 | ( 119 ) |
| 自體MSC-NTF細胞 | 1.0–1.23×10 8細胞/IT,3次給藥 | IIa 期/EUCTR2020-002872-11-NL | 40/前驅期至輕度 AD;50-75歲;MMSE20–30;腦脊液 AD 生物標志物陽性(Aβ42、p-tau) | 招聘可能正在進行或已經結束 | 不適用 | ( 120 ) |
| 非格司亭 (G-CSF) | (I) 10mg/kg/SC,注射5次;(II) 安慰劑(D5W或5%葡萄糖溶液)/SC,注射5次 | 一期、二期/ NCT01617577 | 8/可能AD;>55歲;最小均方誤差10–24 | 完全的 | ADAS-Cog評分:治療后22.25;預處理21.5。PAL(總試驗調整)評分:治療后33.87;預處理28.48。PALmem評分:治療后5.50;預處理 2.75 | ( 121 ) |
| 非格司亭 (G-CSF) | (I)10mg/kg/SC,連續5天,休息11周;每12周重復給藥方案2次;(二)不治療 | 二期/ NCT03656042 | 21/AD診斷;50-85歲;MMSE 12-26;CDR 1-2;改良 Hachinski 缺血評分 4;漢密爾頓抑郁癥精神病評定量表 12 | 完全的 | 不適用 | ( 122 ) |
結論和未來展望
阿爾茨海默病是一種進行性神經退行性疾病,由于干細胞具有獨特的再生能力,它們可能是一種有效的治療選擇。盡管干細胞技術取得了進步,通過鼓勵在AD動物模型中臨床前利用干細胞得到證實,但評估干細胞治療療效的臨床試驗數量有限,許多正在進行的干細胞治療阿爾茨海默病的臨床試驗的結果仍懸而未決。這主要是由于尚未克服的限制,包括技術考慮因素,如時間、劑量和細胞移植的適當程序,這些都沒有明確確定。與任何其他器官移植一樣,干細胞療法的缺點之一是需要免疫抑制。
未來的工作需要解決這些問題。未來需要評估不同來源、類型、干細胞劑量、長期安全性、有效性和精確作用機制的臨床前試驗。
眾多試驗結果表明干細胞治療阿爾茲海默病時不僅能夠調節腦內炎癥性環境,而且促進神經再生和突觸連接,可以有效改善病癥,提高患者生活質量,為更多老年人帶來福音。
參考資料:Karvelas N, Bennett S, Politis G, Kouris NI, Kole C. Advances in stem cell therapy in Alzheimer’s disease: a comprehensive clinical trial review. Stem Cell Investig. 2022 Feb 21;9:2. doi: 10.21037/sci-2021-063. PMID: 35280344; PMCID: PMC8898169.
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加官方微信
掃碼添加官方微信