干細胞治療作為再生醫學的核心領域,在2025年針對2型糖尿病(T2DM)的臨床研究中取得了多項突破性進展。這些進展不僅揭示了干細胞修復胰島功能、調控免疫的核心機制,還通過技術創新和臨床試驗驗證了其長期療效與安全性。
本文基于全球多中心臨床試驗與權威機構報告,系統梳理2025年1月至12月干細胞治療2型糖尿病的最新臨床進展有哪些,為患者呈現前沿動態與科學突破。
2025年1-12月干細胞治療2型糖尿病臨床進展匯總
2025年1月干細胞治療2型糖尿病臨床進展
1月3日,南昌大學科研人員在國際期刊《springer nature》上發表了一篇關于《人類羊膜上皮干細胞——糖尿病及其相關并發癥的潛在治療方法》的研究成果。[1]

研究表明,人胚胚層干細胞(HAESC)為糖尿病治療提供了新思路,主要通過以下方式:
1.改善胰島移植效果:將HAESC整合到胰島類器官中移植到2型糖尿病體內,可顯著降低血糖水平,效果優于單純胰島移植。與血管內皮細胞結合生成“帶血管的胰島”,解決移植后血管重建難題,提高胰島存活率。
2.誘導胰島素分泌:HAESC可分化為能分泌胰島素的細胞,在體外實現葡萄糖依賴性胰島素釋放,有望替代受損β細胞。
3.抗炎與免疫保護:HAESC能分泌抗炎因子,保護胰島免受炎癥損傷,并在移植部位提供局部免疫調節,減少對全身免疫抑制藥物的依賴。
此外,人羊膜上皮干細胞(hAESC)在治療2型糖尿病(T2DM)及其并發癥中展現出多種潛力。它通過調節免疫反應、分泌促進修復的物質、分化為特定細胞類型等機制發揮作用。像糖尿病相關并發癥:
視網膜病變:hAESC還可用于治療2型糖尿病 (T2DM) 的血管并發癥。hAESC可誘導為視網膜色素上皮(RPE)樣細胞或光感受器樣細胞,在動物模型中顯著改善視網膜結構和功能,恢復部分視覺能力。
慢性腎病(CKD):慢性腎病 (CKD) 是2型糖尿病 (T2DM) 的常見合并癥,且兩者的患病率均呈上升趨勢。hAESC通過抑制中性粒細胞、巨噬細胞及效應T/B細胞活性,增強調節性T細胞(Treg)和Th2細胞功能,減輕腎小球損傷,其機制與新月體性腎小球腎炎的免疫調控相似。
綜上所述,本綜述進一步證實,盡管hAESC仍處于研究階段,但它們在治療2型糖尿病并發癥方面擁有巨大的潛力。通過解決當前問題并加深對hAESC作用機制的理解,未來的hAESC治療有望為糖尿病及其相關并發癥患者帶來新的希望。
2025年2月干細胞治療2型糖尿病臨床進展
2月4日,埃及本哈大學醫學院在期刊《Expert Review of Endocrinology & Metabolism》上發表了一篇關于《臍帶間充質干細胞治療1型和2型糖尿病的安全性和有效性:系統評價和薈萃分析》的研究成果。[2]

檢索PubMed、Cochrane、WOS、Embase和Scopus數據庫中截至2024年1月關于UCMSCs治療1型和2型糖尿病的隨機對照試驗(RCT)。共納入334例患者(172例實驗組和162例對照組)的8個CT.
基于8項對照試驗(334例患者)的薈萃分析顯示,間充質干細胞(MSCs)治療2型糖尿病(T2DM)具有以下療效:
1.顯著降低糖化血紅蛋白(HbA1c):MSCs組與安慰劑組相比,HbA1c平均下降0.97%,且研究間無異質性,表明其對血糖控制效果穩定可靠。
2.減少胰島素依賴:MSCs組每日胰島素需求量平均減少0.17 U/kg/d,提示可能部分恢復胰島功能。
3.改善β細胞功能:盡管空腹C肽水平整體無顯著差異,但部分亞組研究顯示MSCs可輕微提升C肽,表明其可能促進殘存β細胞功能或新生β細胞生成。
研究表明MSCs(尤其是UC-MSC)為T2DM提供了降低血糖、減少胰島素依賴的新策略,但需規范治療流程并深入探索其長期作用機制。
2月11日,山東大學齊魯醫院在行業期刊《干細胞移植醫學》上發表了一篇關于《針對糖尿病代謝表型定制細胞療法:不同臍帶來源細胞療法療效的比較研究》的研究成果。[3]
該研究針對2型糖尿病(T2DM)的高度異質性,提出基于個體代謝表型的個性化干細胞治療策略,并系統比較了四種細胞輸注方案的療效與作用機制。

在本研究中,我們針對T2DM進行了4種輸注方案的比較分析,包括單次和多次輸注人臍帶華通膠來源的MSCs(hucMSCs)、單次輸注臍血單個核細胞(UCB)以及序貫輸注hucMSCs和UCB。
結果顯示,所有4種輸注方案在降低空腹血糖水平和抑制胰高血糖素分泌方面均表現出相當的療效。
單次和兩次輸注hucMSCs顯示出遷移到肝臟的趨勢,從而通過增強糖原合成和儲存、促進糖酵解、抑制糖異生和改善胰島素信號轉導來更好地改善肝臟葡萄糖代謝。 hucMSCs 和 UCB 的序貫輸注顯示出對胰腺的特異性細胞趨向性,導致葡萄糖耐量試驗后持續的降糖效果、早期胰島素分泌的恢復、胰島β細胞增殖的刺激以及β/α比例的改善。
多次注射(無論何種細胞類型)均能降低全身慢性炎癥標志物(例如 IL-1β、IL-6、IL-17、IL-22 和 IFN-γ)的表達。
最后,單劑量UCB表現出更強的靶向內臟脂肪的趨勢,并增強了調節總膽固醇和甘油三酯水平的有效性。
總而言之,我們的研究為不同的2型糖尿病代謝表型提供了個性化的干細胞治療方案,從而為未來的臨床試驗和應用提供了更好的治療方案。
2025年5月干細胞治療2型糖尿病臨床進展
5月19日,馬來西亞科研人員在國際知名期刊《糖尿病、代謝綜合征與肥胖》上發表了一篇關于《臍帶間充質干細胞輸注治療2型糖尿病患者:一項回顧性細胞學注冊研究》的研究成果。[4]

本研究旨在通過多種臨床評估,評估靜脈輸注同種異體臍帶間充質干細胞 (UC-MSCs) 對2型糖尿病患者的臨床療效,重點關注全身炎癥、代謝功能障礙和胰島素抵抗。共選擇了301名糖尿病患者,符合納入和排除標準。研究結果表明:
1.炎癥與血糖控制:基線hs-CRP≥1.5 mg/L的患者,經 UC-MSCs 治療后,6個月時hs-CRP呈下降趨勢,12個月時顯著降低;同時糖化血紅蛋白(HbA1c)同步下降,表明該療法可減輕炎癥并改善血糖控制。
2.心血管功能:UC-MSCs輸注使患者收縮壓和舒張壓顯著下降,提示其可能通過改善血管功能、減輕炎癥和代謝障礙,帶來心血管獲益。
3.肝功能修復:治療6個月后,γ- 谷氨酰轉肽酶(GGT)和丙氨酸氨基轉移酶(ALT)水平顯著降低。作為肝細胞損傷標志物,二者下降表明 UC-MSCs 可通過調節炎癥和代謝,改善非酒精性脂肪性肝病(NAFLD)相關的肝臟損害。
4.腎臟保護作用:約24%的患者存在腎功能損傷(eGFR<60 mL/min/1.73 m2),其中 CKD 2期患者經治療后 eGFR 顯著升高、肌酐水平下降;晚期CKD患者的尿素氮(BUN)從異常降至正常范圍,表明UC-MSCs可延緩糖尿病腎病進展,促進腎臟修復。
5.性激素調節:12個月隨訪顯示,男性睪酮和女性雌二醇水平顯著升高。睪酮和雌二醇可分別通過增強葡萄糖轉運和胰島素敏感性,改善糖尿病患者的代謝功能。
此外,治療過程中尿酸水平無顯著變化,表明UC-MSCs主要作用于腎臟功能和炎癥調節,而非尿酸代謝。總體而言,UC-MSCs通過多系統調節,在減輕炎癥、改善代謝和保護靶器官等方面展現出治療2型糖尿病的潛力。
相關閱讀:干細胞治療2型糖尿病前沿:301例患者實現炎癥與血糖的雙重改善
5月19日,日本HELENE診所發布了一項長期臨床研究證實,間充質干細胞(MSC)單次靜脈注射療法可顯著改善2型糖尿病(T2DM)患者的血糖控制,療效持續超三年,且安全性良好。這項為期68個月的追蹤研究首次揭示,高劑量 MSC 治療對重度糖尿病患者效果尤為突出,為糖尿病再生醫學帶來革命性突破。[5]
研究納入61名HbA1c(血糖控制金標準)>6.2% 的 T2DM 患者,平均年齡66歲,接受單次MSC靜脈注射(劑量1億至20億細胞)。結果顯示:
- 整體療效顯著:患者平均 HbA1c從治療前的7.49%降至6.7%,接近正常水平;
- 重度患者獲益更大:基線HbA1c>8%的重度組患者,HbA1c平均下降1.55%,降幅是中度組(0.58%)的近3倍;
- 療效持久穩定:追蹤期間療效未隨時間遞減,證實單次注射即可實現三年以上持續控糖,無需重復治療;
- 劑量依賴性優勢:高劑量組(210億細胞)HbA1c下降趨勢更顯著,其中>15億細胞組平均降幅達1.72%,顯示劑量越高,控糖效果越優。
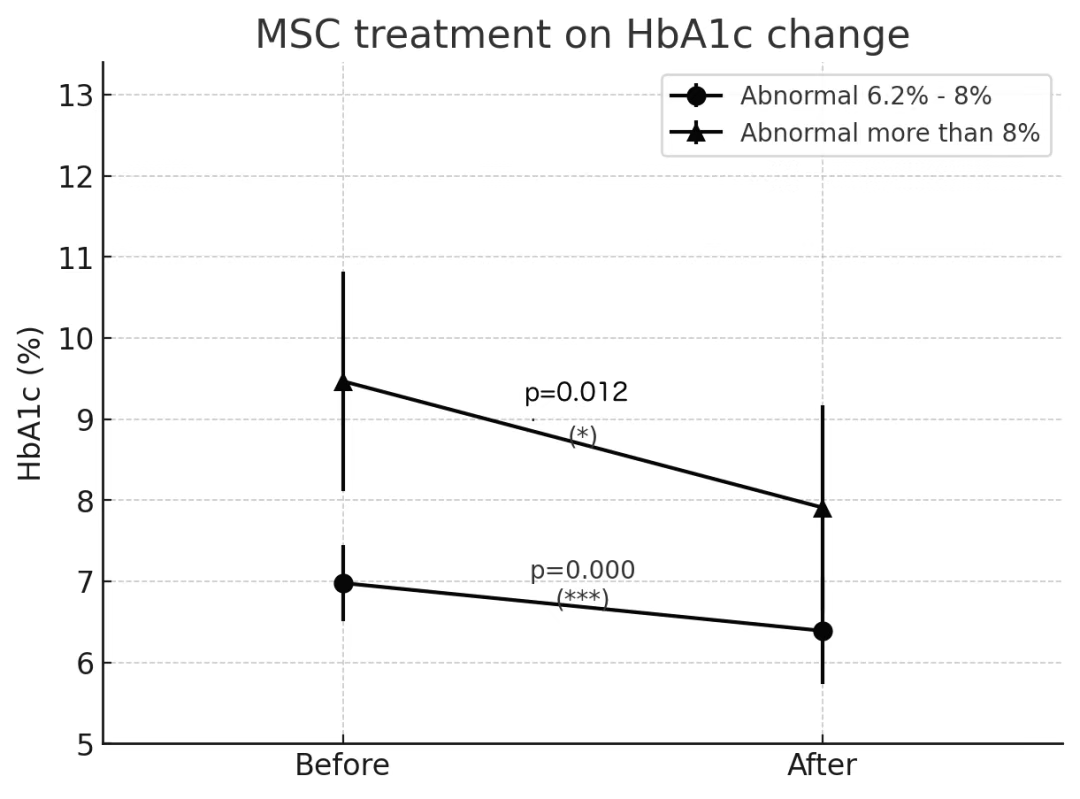
研究中未觀察到與 MSC 治療相關的嚴重不良事件,證實其安全性。對于需終身服藥或注射胰島素的糖尿病患者,單次 MSC 治療即可長效控糖的特性具有顛覆性意義:
- 簡化治療流程:尤其適合不便頻繁就診或追求低侵入性治療的患者;
- 精準靶向重癥:重度患者的顯著療效為晚期糖尿病干預提供了新選擇;
- 降低并發癥風險:通過修復血管內皮與抑制炎癥,有望減少糖尿病足腎病、視網膜病變等遠期并發癥。
這項研究首次證明,糖尿病可能從”‘終身慢性’病轉變為’可通過一次性細胞療法控制的疾病’。”研究負責人指出,“未來,干細胞療法或重塑糖尿病治療格局,讓’一次治療、長期獲益’成為現實。
5月20日,海軍軍醫大學(第二軍醫大學)第一附屬醫院在《海軍軍醫大學學報》上報告了一項名為《間充質干細胞治療糖尿病的研究進展》的匯總成果。[6]

該報告系統梳理了間充質干細胞(MSCs)在糖尿病治療中的臨床證據與作用機制,揭示了這一前沿技術在改善血糖控制、修復胰島功能及防治并發癥方面的巨大潛力。
其中關于2型糖尿病,該綜述報告指出,在解放軍總醫院開展的一項隨機雙盲對照試驗中,73名2型糖尿病患者接受了臍帶間充質干細胞(UC-MSCs)靜脈輸注。治療48周后,20%的患者實現了糖化血紅蛋白(HbA1c)<7.0%且胰島素用量減少50%以上的目標,而安慰劑組僅4.55%達到這一標準。更令人振奮的是,治療組中有5名患者在10-13個月內完全脫離胰島素依賴,這在傳統治療中幾乎不可能實現。
此外,還有一項研究顯示,接受臍帶華通氏膠MSCs移植的2型糖尿病患者中,41%在2-6個月內停用胰島素,且平均9.3個月無需再注射胰島素。這些數據表明,MSCs治療不僅能顯著改善血糖控制,更能實現長期療效。
2025年6月干細胞治療2型糖尿病臨床進展
6月3日,利比亞米蘇拉塔國家癌癥研究所牽頭在《糖尿病與代謝綜合征》雜志上發表了一篇名為《間充質干細胞治療1型和2型糖尿病:隨機對照試驗的系統評價和薈萃分析》的研究成果。[7]

本綜述回顧并分析了13項RCT,共涉及507名受試者。其中,我國進行了5項研究,印度進行了3項研究,伊朗進行了 2項研究,瑞典進行了2項研究,美國進行了1項研究。
我們觀察到糖尿病患者的糖化血紅蛋白 (HbA1c)、前血糖 (PPBG) 和胰島素需求量在接受干細胞治療六個月和十二個月后持續顯著降低。空腹C肽水平(可指示β細胞功能和基線胰島素分泌)在兩種類型的患者中在12個月的隨訪后也顯著升高。
在半年和一年的隨訪中,在T2DM亞組分析中,FBG、PPBG和胰島素劑量在一年后顯著降低;后兩者在3個月和6個月也持續降低。
兩組間空腹血糖(FBG)無顯著差異,但干預組在治療后3、6和12個月的空腹血糖持續較低。此外,MSC療法在改善刺激后C肽、胰島素抵抗指數(HOMA-IR)和HOMA-B指標方面未見明顯效果。
2025年7月干細胞治療2型糖尿病臨床進展
7月25日,安徽醫科大學第五臨床醫學院在《罕少疾病雜志》上發表了一篇題為《人臍帶充質干細胞治療2型糖尿病的一例報告并文獻復習》的研究報告,給廣大糖尿病患者帶了康復的新希望。[8]

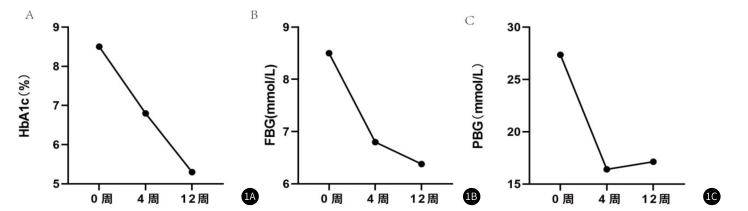
該研究選取的是1名確診為2型糖尿病60歲男性患者,因20年前口干、多飲、多尿,血糖升高,診斷為2型糖尿病,有高血壓病史。6年前因血糖控制不佳,調整治療方案為門冬胰島素30注射液18U 三餐前、甘精胰島素注射液8U 睡前、曲格列汀100mg 每日1次+飲食運動治療,血糖控制差,HbA1C:8.5%,空腹c肽:807pmol/L。
最終確診為:2型糖尿病合并糖尿病視網膜病變、高血壓和脂肪肝。在常規治療收效甚微后,醫療團隊制定了周密的干細胞治療方案。
2022年6月19號于北京大學深圳醫院內分泌科接受三次臍帶間充質干細胞(hUC-MSCs)靜脈注射。研究結果發現:
1.血糖明顯改善:在隨訪過程中,患者第4、12周糖化血紅 蛋 白 均 控 制 達 標 , 其 中 在 第 1 2 周 , 糖 化 血 紅 蛋 白 降至最低,為5.3%;在隨訪過程中,患者空腹血糖(Fastingblood glucose,FBG)持續下降。餐后2小時血糖(2-hour postprandial blood glucose,PBG)均低于基線水平。(圖1)
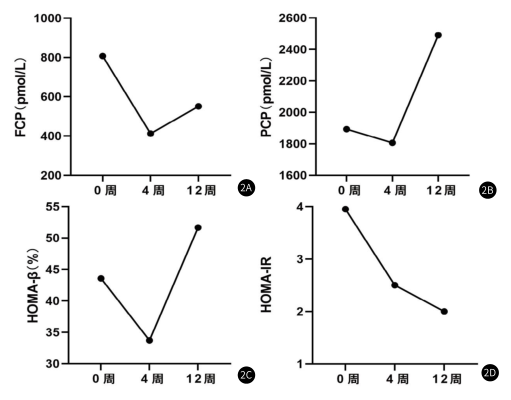
2.胰島功能逐步改善:靜脈輸注臍帶間充質干細胞后,患者FCP在第4周下降至最低,隨后上升;而PCP在輸注臍帶間充質干細胞后,在4周后開始上升至12周;就HOMA-β而言,在4周后開始上升,于12周到達高值;而HOMA-IR,在輸注hUC-MSCs后持續下降至12周,胰島功能恢復與胰島素抵抗減輕均于12周到達最佳效果。
3.逐漸減少降糖藥:患者在前三次輸注臍帶間充質干細胞后逐漸實現降糖藥物減量,到第4周實現了減停口服降糖藥物,到4周胰島素用量較基線胰島素用量下降大于50%。(見表1)

4.安全性:整體來看,治療安全性良好。余心電圖、胸片、感覺閾值未見明顯異常,未見肺部、肝膽脾胰等臟器出現新發結節/腫瘤等情況,隨訪過程中未出現感染、嚴重低血糖及急性心腦血管等事件。
病例表明,靜脈輸注人臍帶間充質干細胞(UC-MSCs)可能成為2型糖尿病的安全有效干預策略,其通過改善糖化血紅蛋白(HbA1c)水平、部分性恢復胰島β細胞功能及減輕胰島素抵抗三重機制,為疾病管理提供新型治療選擇。
7月26日,西哈薩克斯坦醫科大學牽頭在《世界干細胞雜志》上發表了一篇名為《自體和異體間充質干細胞治療糖尿病:系統評價和薈萃分析》的研究成果。[9]
本系統綜述分析了2000年至2025年間發表的研究,重點關注自體和異體MSC治療2型糖尿病的安全性、有效性和治療潛力。

薈萃分析顯示,骨髓來源的間充質干細胞(MSCs)治療2型糖尿病能顯著降低患者的HbA1c、空腹血糖(FBG)和胰島素用量,同時對C肽水平的影響有限。
具體來看,自體MSCs移植可以明顯降低HbA1c、FBG和胰島素需求,而同種異體MSCs對HbA1c的影響不顯著,但可以降低FBG和胰島素用量。
在安全性方面,基于MSC的治療總體耐受良好,不良反應大多為短期輕微反應,僅少數參與者出現,且迄今未觀察到嚴重或致命事件。整體來看,這類療法在有效性和安全性上都展現出良好的潛力,為糖尿病治療提供了可行的新方向。
2025年8月干細胞治療2型糖尿病臨床進展
8月22日-24日,2025廣州醫療與健康產業博覽會(以下簡稱“醫博會”)在廣州盛大舉行,一則重磅消息在現場引發廣泛關注:國家Ⅰ類新藥干細胞治療二型糖尿病臨床啟動發布會,正式啟動干細胞治療二型糖尿病臨床項目。[10]

活動上,中山大學附屬第一醫院內分泌科劉娟教授指出,我國糖尿病患者眾多,目前尚無根治方法,現有治療主要是控制并發癥。干細胞治療作為全球新興的疾病干預手段,已積累了大量成功案例,有望成為繼手術和藥物之后的新型糖尿病治療方向。
2型糖尿病的核心問題在于β細胞與胰島素敏感組織(肝、肌肉、脂肪)之間的反饋失衡,導致葡萄糖代謝異常。現有藥物只能在一定程度上延緩病情或改善癥狀,但無法阻止 β 細胞持續損傷,并可能帶來胰腺炎、心血管等風險。
而間充質干細胞(MSCs)具有多向分化和免疫調節能力,能夠誘導分化為胰島素分泌細胞,促進胰腺再生,為糖尿病治療提供了新的希望。
此次臨床項目采用達博生物自主研發的人臍帶間充質干細胞注射液,可保護內源性β細胞,緩解與胰島素抵抗相關的慢性輕度炎癥。今年7月,廣州開發區(黃埔區)也發布了促進生物醫藥產業發展的政策,從資金、審批、國際拓展到產業生態全鏈條給予支持。廣州市黃埔區衛生健康局表示,將繼續支持干細胞創新藥和細胞治療產業的發展,此次臨床項目的啟動也增強了國內干細胞產業信心。
2025年9月干細胞治療2型糖尿病臨床進展
2025年9月,國家藥品監督管理局近期已正式接收 “E10I 人臍帶間充質干細胞注射液” 的新藥臨床試驗申請。值得關注的是,這是我國首款無需進行基因修飾的天然干細胞療法,其治療方向專門聚焦于2型糖尿病。[11]
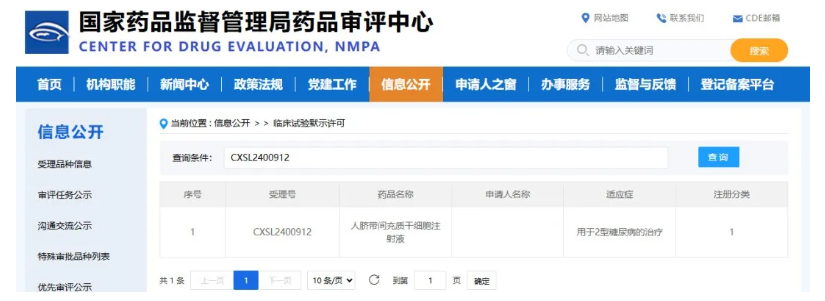
這標志著我國在糖尿病細胞治療領域邁出關鍵一步,也為數以百萬計的2型糖尿病患者打開了新的治療窗口。
在此前的研究中,E10I注射液通過靜脈輸注方式進行治療(每4周一次,共3次),結果顯示出令人振奮的療效:
- 血糖達標時間延長30%以上,血糖波動顯著減少;
- 糖化血紅蛋白(HbA1c)下降1.2%–1.5%,長期血糖控制更為穩定;
- 部分患者胰島素用量減少超過20%,對外源胰島素依賴明顯降低;
- 療效可持續6–12個月,為患者帶來持久的代謝改善與生活質量提升。
這項療法的臨床推進,不僅展示了我國干細胞研究的創新實力,也為“擺脫終身胰島素依賴”提供了新的可能。未來,隨著更多臨床數據積累,E10I或將成為2型糖尿病精準細胞治療的新里程碑。
2025年10月干細胞治療2型糖尿病臨床進展
10月20日,行業權威期刊《護理實踐與研究》發表了一篇題為《臍帶間充質干細胞喚醒 20 年糖友:從依賴胰島素到自主控糖的重生之路》的臨床成果報告。[12]
研究依托成渝雙城區域細胞制備協同創新中心(簡稱成渝雙城細胞中心)的技術支撐,通過真實案例展現了臍帶間充質干細胞治療2型糖尿病的顯著成效,為長期受困于該疾病的患者提供了新的康復方向。

患者張建國(化名),55歲,罹患2型糖尿病20年,長期依賴胰島素且出現周圍神經病變和糖尿病腎病。
在接受3次間隔4周的hUC-MSCs靜脈輸注后,血糖明顯下降,糖化血紅蛋白從8.5%降至6.8%,并在3個月內完全停用胰島素,同時足部疼痛緩解,睡眠改善,生活質量顯著提升。
遠期隨訪顯示,糖穩持續,尿蛋白下降,神經功能改善,生活質量提高,且未出現嚴重不良反應。
該案例表明,臍帶間充質干細胞通過調節免疫、改善胰島素抵抗并修復β細胞功能,可從根本上改善糖代謝紊亂。而貫穿全程的專業護理是療效和安全性的重要保障,為長期2型糖尿病患者提供了全新的康復路徑。
10月21日,伊朗德黑蘭科研人員在《分子生物學報告》上發表了一篇名為《間充質干細胞治療2型糖尿病:機制、臨床證據和未來方向》的研究成果。[13]
究指出,2型糖尿病的核心問題在于胰島素抵抗與β細胞功能衰退,傳統藥物雖能控制血糖,卻難以逆轉病程。
MSC憑借免疫調節、抗炎修復及旁分泌作用,能保護β細胞、改善胰島素敏感性并促進組織修復,從多環節干預糖尿病的病理過程。相比其他干細胞類型,MSC來源廣、取材安全、免疫排斥風險低且具備成熟的GMP生產體系,因此在臨床研究中占據主導地位。
過去二十年,全球多項臨床試驗驗證了MSC在降低糖化血紅蛋白、減少胰島素用量及改善代謝功能方面的潛力。
特別是臍帶來源MSC因無創獲取、細胞活性高而成為應用熱點。最新的薈萃分析顯示,MSC治療可使HbA1c平均下降0.7%以上,并顯著改善C肽水平。
研究者認為,未來應聚焦于建立標準化生產體系、開展多中心隨機對照試驗,并開發預測性生物標志物,以推動MSC療法從臨床探索邁向常規治療,為2型糖尿病帶來真正的再生醫學突破。
2025年11月干細胞治療2型糖尿病臨床進展
11月23日,意大利多家科研機構聯合在《Journal of Diabetes and its Complications》上發表了一篇名為《再生醫學在糖尿病治療中的應用:當前進展與未來方向》的研究成果。[14]

該綜述系統總結了再生醫學在糖尿病治療中的最新進展,指出 2型糖尿病的核心問題并不僅是胰島素抵抗,而是胰島β細胞功能的進行性衰竭。研究顯示,患者出現臨床癥狀時,約 50%的β細胞已失去功能,且這一過程會持續加重,單純依賴藥物和胰島素治療難以從根本上逆轉病程。
在此背景下,干細胞及再生醫學提供了新的治療思路。多項研究表明,干細胞分化得到的β樣細胞能夠在體內對葡萄糖刺激作出反應,分泌胰島素,具備替代或補充受損β細胞的潛力。與傳統胰島移植相比,低免疫原性的干細胞來源β細胞有望降低免疫排斥風險,并減少對長期免疫抑制藥物的依賴。
此外,研究還指出,生物材料封裝技術和細胞保護策略可提高移植細胞在體內的存活率和功能穩定性,使干細胞治療在2型糖尿病中的應用更具可行性。盡管目前仍面臨長期安全性、免疫逃逸和規模化生產等挑戰,但現有臨床和早期試驗結果已表明,基于干細胞的β細胞替代療法,有望成為未來改善甚至逆轉2型糖尿病進程的重要方向。
2025年12月干細胞治療2型糖尿病臨床進展
12月16日,我國科研人員在《Free Radical Biology and Medicine》上發表了一篇名為《通過調控人骨髓間充質干細胞,靶向鐵死亡和鐵蛋白自噬可改善2型糖尿病患者拔牙窩的愈合》的研究成果。[15]

研究發現,2型糖尿病患者拔牙后恢復慢,并不只是“血糖高”這么簡單。在高糖環境下,骨髓間充質干細胞容易發生一種叫做“鐵死亡”的異常細胞死亡過程,本質上是體內鐵過多、氧化壓力過強,把修復骨頭的細胞“耗死了”,從而影響牙槽骨和創口的正常愈合。
進一步研究顯示,鐵死亡的核心機制是鐵蛋白自噬異常活躍,它會釋放大量游離鐵,引發連鎖氧化損傷。科研團隊開發的一種新型水凝膠(NBP@BP@CS)可以同時清除自由基、減輕氧化應激,并調節鐵代謝和干細胞功能。在動物實驗中,這種水凝膠顯著加快了糖尿病狀態下拔牙創口的愈合,為改善糖尿病患者術后恢復和骨愈合困難提供了新的治療策略。
2025年干細胞治療2型糖尿病進展總結
綜上所述,2025年的多項干細胞治療2型糖尿病研究揭示了這一領域的重要突破:從細胞移植到個性化方案,從單器官修復到全身代謝調節,干細胞療法展現出多維度的治療潛力。其核心意義在于:
1.突破傳統治療局限:干細胞不僅直接修復受損胰島,還能通過抗炎、免疫調節、促進血管生成等機制,系統性改善血糖控制、延緩并發癥進展,為依賴胰島素的患者提供“功能性治愈”新希望。
2.推動精準醫療:山東大學等團隊提出的“基于代謝表型定制治療”的理念,標志著糖尿病治療從“一刀切”向精準化轉型,不同細胞來源針對肝臟、胰腺、內臟脂肪等靶器官的差異化干預,為個體化方案設計奠定基礎。
3.解決臨床瓶頸:臍帶間充質干細胞在301例大樣本研究中證實的安全性、馬來西亞研究中肝腎功能的顯著改善,以及海軍軍醫大學實現“完全脫離胰島素依賴”的突破,均表明干細胞療法具備從實驗室向臨床轉化的可行性。
4.多學科交叉前景:干細胞與生物材料(如透明質酸水凝膠)、基因編輯、AI輔助分型等技術的結合,有望進一步優化治療效率,推動糖尿病管理進入“細胞+”時代。
挑戰與未來方向
當前的難點在于如何在“標準化”和“個性化”之間找到平衡——不同來源的干細胞(臍帶、脂肪、骨髓)和不同給藥方式(靜脈輸注、局部移植等)效果并不一致,需要進一步優化并明確最佳劑量和途徑;同時也要開展多中心隨機對照試驗來驗證長期療效。
技術上,可以借助人工智能來優化體外分化條件,開發能實時追蹤移植細胞功能的生物傳感器;在臨床應用層面,亟需降低成本、推動醫保覆蓋,并探索干細胞與藥物、生活方式干預或其它療法的聯合方案,以實現協同增效。
結語
2025年的進展讓人看到希望——干細胞治療正從單純的“癥狀控制”向恢復功能、延緩或逆轉病程的方向靠近。只要后續研究把療效、安全性和可及性的問題一步步解決,配合合理的監管與支付政策,這一途徑有望在未來幾年內惠及更多糖尿病患者,成為綜合治療的重要組成部分。
相關閱讀:2025年干細胞治療1型糖尿病最新臨床進展,治愈已觸手可及(截至5月)
參考資料:
[1]Chen, Z., Luo, Y. & Liu, J. Human amniotic epithelial stem cells, a potential therapeutic approach for diabetes and its related complications. Human Cell 38, 39 (2025). https://doi.org/10.1007/s13577-024-01171-x
[2]Nada AH, Ibrahim IA, Oteri V, Shalabi L, Asar NK, Aqeilan SR, Hafez W. Safety and efficacy of umbilical cord mesenchymal stem cells in the treatment of type 1 and type 2 diabetes mellitus: a systematic review and meta-analysis. Expert Rev Endocrinol Metab. 2025 Mar;20(2):107-117. doi: 10.1080/17446651.2025.2457474. Epub 2025 Feb 4. PMID: 39905688.
[3]Wang L, Wang L, He F, Song J, Qiao J, Qin J, Chen L, Hou X. Tailoring cell therapies for diabetic metabolic phenotypes: a comparative study on the efficacy of various umbilical cord-derived cell regimens. Stem Cells Transl Med. 2025 Feb 11;14(2):szae083. doi: 10.1093/stcltm/szae083. PMID: 39560969; PMCID: PMC11878779.
[4]Chin SP, Kee LT, Mohd MA, Then KY. Umbilical Cord-Derived Mesenchymal Stem Cells Infusion in Type 2 Diabetes Mellitus Patients: A Retrospective Cytopeutics’ Registry Study. Diabetes Metab Syndr Obes. 2025 May 19;18:1643-1659. doi: 10.2147/DMSO.S507801. PMID: 40416928; PMCID: PMC12102742.
[5]https://bydrug.pharmcube.com/news/detail/15f21f78cf686cba6ab851ab21312c14
[6]金愷萌,魯瑾.間充質干細胞治療糖尿病的研究進展[J].海軍軍醫大學學報,2025,46(05):644-652.DOI:10.16781/j.CN31-2187/R.20240199.
[7]Kashbour, M., Abdelmalik, A., Yassin, M.N.A. et al. Mesenchymal stem cell-based therapy for type 1 & 2 diabetes mellitus patients: a systematic review and meta-analysis of randomized controlled trials. Diabetol Metab Syndr 17, 189 (2025). https://doi.org/10.1186/s13098-025-01619-6
[8]黃才浩,張帆.人臍帶充質干細胞治療2型糖尿病的一例報告并文獻復習[J].罕少疾病雜志,2025,32(07):3-6.
[9]Aringazina RA, Zare A, Mousavi SM, Abenova N, Mussin NM, Tamadon A. Autologous and allogeneic mesenchymal stem cell-based therapies for diabetes mellitus: A systematic review and meta-analysis. World J Stem Cells 2025; 17(7): 108202
[10]https://mp.weixin.qq.com/s/yCh4Lz3nfhN5jJM_O6uA_w
[11]https://mp.weixin.qq.com/s/LCiMJumtFvvd4z9uAZX9HA
[12]霍光同.臍帶間充質干細胞喚醒20年糖友:從依賴胰島素到自主控糖的重生之路[J].護理實踐與研究,2025,22(10):1424-1426.
[13]Zarei M. Mesenchymal stem cell therapy for type 2 diabetes: mechanisms, clinical evidence, and future directions. Mol Biol Rep. 2025 Oct 21;52(1):1046. doi: 10.1007/s11033-025-11133-7. PMID: 41117868.
[14]Medenica S, Abazovic D, Vukovic J, Vojinovic T, Tomovic F, Defeudis G, Mazzilli R, Kovacevic Z, Djurdjic D, Prelevic V, Abazovic T, Rizzo M, Abdelalim EM. Regenerative medicine approaches for treating diabetes: Current advances and future directions. J Diabetes Complications. 2026 Jan;40(1):109232. doi: 10.1016/j.jdiacomp.2025.109232. Epub 2025 Nov 23. PMID: 41297146.
[15]Li J, Xu F, Yu Y, Guo F, Chen Z, Cheng Z, Qin R, Yuan H, Ma X, Du Y, Bian Y, Pan Y. Targeting ferroptosis and ferritinophagy improves tooth extraction socket healing in type 2 diabetes mellitus via human bone marrow mesenchymal stem cells modulation. Free Radic Biol Med. 2025 Dec 16;241:732-747. doi: 10.1016/j.freeradbiomed.2025.10.010. Epub 2025 Oct 11. PMID: 41082952.
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加官方微信
掃碼添加官方微信